Значение белки в желудке
белка в целом. Именно поэтому денатурированные нагреванием белки (т.е. подвергшиеся термообработке мясные и рыбные продукты, вареные яйца), а также белки, набухшие под действием соляной кислоты желудочного сока, перевариваются значительно эффективнее, чем белки нативные, хотя при этом их первичная структура остается одинаковой. Протеиназы, входящие в состав желудочного, поджелудочного и кишечного соков воздействуют на пептидные связи в различных участках полипептидных цепей. Поэтому, только в результате комбинированного воздействия всего комплекса протеолитических ферментов желудочно-кишечного тракта осуществляется гидролиз белков до конечных продуктов, представленных свободными аминокислотами, а также ди- и трипептидами, которые всасываются эпителиальными клетками тонкого кишечника.
Рис. 2.3 Схема, отражающая последовательные стадии расщепления белков до аминокислот, ди- и трипептидов в желудочно-кишечном тракте (Textbook of Biochemistry with clinical correlations, Devlin T.M., (ed.), WILEY-LISS, 1993).
Таким образом, как показано на рис. 2.3, процесс переваривания белков может быть условно разделен на желудочную, панкреатическую и интестинальную фазы, в зависимости от участия тех или иных протеиназ, имеющих соответствующее происхождение.
Хорошо известно, что в полости рта белки никаким изменениям не подвергаются вследствие отсутствия в слюне протеолитических ферментов. Переваривание белков начинается в желудке. Выделяют три основных фактора, обеспечивающих инициацию процесса переваривания:
−стимуляция выделения гастрина присутствием белка пищи в желудке;
−в свою очередь гастрин обеспечивает секрецию обкладочными клетками слизистой желудка соляной кислоты;
−секреция пепсиногена главными клетками слизистой желудка.
Желудочный сок характеризуется присутствием высокой концентрации HCl и, следовательно, низким значением рН (рН ≈ 2.0), а также наличием протеиназ семейства пепсина. Высокая кислотность содержимого желудка имеет чрезвычайно важное физиологическое и биохимическое значение:
−во-первых, сильно кислая среда обеспечивает набухание и денатурацию пищевых белков. При этом глобулярные белки утрачивают третичную структуру, вследствие чего внутренние петидные связи становятся доступными для действия протеиназ;
−во-вторых, присутствие соляной кислоты обеспечивает инициацию аутокаталитического процесса превращения пепсиногена в пепсин и создает оптимальные условия для проявления его протеолитической активности. Так, оптимальное значение pH желудочного сока для нормального функционирования пепсина человека составляет 1,5-2,5. При pH 5-6 пепсин практически не проявляет протеолитической активности.
−наконец, высокая концентрация соляной кислоты препятствует развитию
вполости желудка микрофлоры, действуя как антисептик, тем самым, предотвращая зарождение гнилостных процессов. Хорошо известно, что при гастритах, при недостаточной кислотности желудочного сока гнилостные процессы в желудке являются причиной появления у больных неприятного запаха изо рта.
Влабораторной клинической практике для тестирования состояния желудка обычно определяют как «свободную» соляную кислоту, так и общую кислотность желудочного сока. Для этого, определенный объем желудочного сока титруют 0,1 N раствором щелочи в присутствии индикаторов – фенолфталеина для определения общей кислотности и диметиламидоазобензола при определении свободной HCl. Область перехода окраски фенолфталеина лежит в пределах pH 8,2-10,0, что позволяет определить всю совокупность кисло реагирующих веществ (свободная HCl, кислота, связанная с белками, фосфаты, органические кислоты и др.) в желудочном соке.
Диметиламидоазобензол изменяет окраску в пределах значений pH 2,4-4,0. Эта область pH соответствует моменту нейтрализации щелочью практически всей свободной HCl. Кислотность желудочного сока выражают
вмиллилитрах 0,1N раствора NaOH, расходуемого на титрование 100 мл сока – титрационных единицах.
При нормальной функции желудка общая кислотность колеблется обычно в пределах 40-60 титрационных единиц, а свободная соляная кислота
-20-40 единиц.
Внастоящее время разработаны беззондные методы определения кислотности желудочного сока. Суть этих методов состоит в использовании ионообменных смол с присоединенным хинином. При введении такой смолы
вполость желудка соляная кислота связывается с катионитом, вытесняя хинин, который всасывается в кровь и выводится из организма с мочой. По количеству выделившегося хинина судят о содержании HCl в желудочном соке.
Действие пепсина
Важнейшую роль в переваривании белков в желудке играет протеиназа – пепсин, который секретируется главными клетками слизистой желудка в каталитически неактивной форме – в виде пепсиногена. Активный пепсин образуется из предшественника – пепсиногена (мол. масса 40.000 дальтон) при удалении 44 аминокислотных остатков с N-конца белковой молекулы. Расщепление пептидной связи между аминокислотными остатками в положениях 44 и 45 в пепсиногене может происходить либо посредством автоактивации внутримолекулярной реакции гидролиза при рН ниже 5.0, либо в присутствии следов пепсина за счет автокатализа. Освобождающийся N-концевой пептид остается связанным с остальной частью молекулы фермента и действует как ингибитор пепсина при рН выше 2.0. Этот ингибирующий эффект устраняется либо при снижении рН до значений меньших 2.0, либо в результате дальнейшей деградации N- концевого пептида под действием пепсина. Далее образовавшийся пепсин активирует другие молекулы пепсиногена и весь процесс приобретает лавинообразный характер.
Пепсины являются уникальными белками хотя бы потому, что чрезвычайно устойчивы к действию кислот. Фактически эти протеиназы активны только в сильно кислой среде и не активны при нейтральном значении рН. Механизм катализа зависит от присутствия в активном центре фермента двух карбоксильных групп, принадлежащих двум остаткам аспарагиновой кислоты, причем одна карбоксильная группа находится в ионизованной форме, а другая в недиссоциированном состоянии. По этой причине пепсины относят к семейству карбоксипротеиназ. Характерной особенностью карбоксипротеиназ является их ингибирование пепстатином,
который оказывает ингибирующее действие в очень низких концентрациях, порядка 10-10 М.
Основной желудочной протеиназой является пепсин А (мол. масса 33.000 дальтон), который преимущественно расщепляет пептидные связи,
образованные аминогруппами ароматических аминокислот – тирозина,
фенилаланина и триптофана, а также связи Ala-Ala и Ala-Ser. Нервнорефлекторные механизмы отделения желудочного сока и
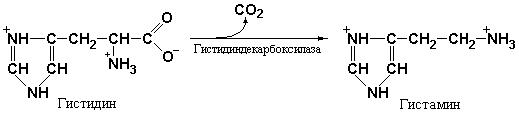
регуляция желудочной секреции достаточно подробно рассматриваются в курсах физиологии. Тем не менее, необходимо остановиться на некоторых аспектах действия гуморальных факторов. К числу таких факторов относится гистамин, являющийся продуктом декарбоксилирования аминокислоты гистидина под действием гистидин-декарбоксилазы (рис. 2.4) и «пищеварительный» гормон гастрин, выполняющий наиболее важную роль в стимуляции секреции желудочного сока. Образование гастрина в слизистой оболочке привратника желудка и поступление его в кровь резко усиливается при поступлении в желудок пищи.
Рис. 2.4 Гистамин является продуктом декарбоксилирования аминокислоты гистидина под действием гистидин-декарбоксилазы
Сравнение активностей этих двух факторов показывает, что полипептид гастрин обладает в 500 раз более высокой способностью стимулировать функцию желудка, чем гистамин. Однако, при введении человеку даже 1 мг гистамина в кровь, обнаруживается интенсивное отделение желудочного сока. Подобная гистаминовая проба используется в лабораторной клинической практике для дифференциальной диагностики ахилий – патологических состояний, характеризующихся неспособностью желудка секретировать пепсин и HCl. Отсутствие секреции в ответ на введение гистамина свидетельствует об атрофическом изменении слизистой желудка. В ходе активации пепсина не весь пепсиноген принимает участие в этом процессе. Частично пепсиноген всасывается в кровь, доставляется в почки и переходит в состав мочи. Присутствующий в моче пепсиноген получил специальное название уропепсиногена. В клинических лабораториях, особенно в педиатрической практике, часто определяется активность уропепсиногена (уропепсина) для оценки функционального состояния и секреторной функции слизистой желудка у детей. При пониженной секреции желудочного сока и при наличии атрофических процессов активность уропепсина резко снижается, а при гиперсекреторных состояниях, например при язвенной болезни – повышается.
В клинической практике определяют также активность пепсина, особенно при отсутствии свободной HCl в желудочном соке. Это позволяет отличать анацидные состояния (отсутствие HCl при наличии пепсина) от истинных ахилий, при которых секреция желудка практически отсутствует.
Основными продуктами гидролиза белка под действием пепсина являются большие пептидные фрагменты и некоторое количество свободных аминокислот. Значение переваривания белков в желудке сводится, в первую очередь, к появлению пептидов и аминокислот, которые действуют в качестве стимуляторов синтеза и выброса холецистокинина. Поэтому пептиды, образованные в результате гидролитического расщепления пищевых белков под действием желудочных протеиназ, являются инструментом инициации панкреатической фазы переваривания белка.

Лекция № 3
Переваривание белков в тонком кишечнике. Активация панкреатических зимогенов
Как только кислое содержимое желудка попадает в тонкий кишечник, в нем под влиянием низкого pH начинается секреция гормона секретина, поступающего в кровь. Секретин, в свою очередь стимулирует выделение поджелудочной железой бикарбоната, что приводит к нейтрализации HCl желудочного сока. В результате pH резко возрастает от 1,5-2,5 до ~7,0. При нейтральном значении pH в тонком кишечнике продолжается переваривание белков под действием протеиназ поджелудочной железы. Секреция этих протеиназ стимулируется гормоном холецистокинином, продукция которого зависит от поступления в двенадцатиперстную кишку свободных аминокислот.
Пищеварительный сок поджелудочной железы содержит большое количество проэнзимов эндопептидаз и карбоксипептидаз. Эти зимогены активируются только после того, как попадут в просвет тонкого кишечника. Ключевым ферментом, ответственным за их активацию, является энтерокиназа – протеиназа, продуцируемая эпителиальными клетками двенадцатиперстной кишки. Энтерокиназа активирует панкреатический трипсиноген посредством отщепления гексапептида NH2 – Val – (Asp)4 – Lys с N-конца этого зимогена, превращая его тем самым в активный трипсин
(рис. 3.1).
Рис. 3.1 Схема, иллюстрирующая процесс активации трипсина под действием энтерокиназы.
Далее активный трипсин способен автокаталитически активировать другие молекулы трипсиногена. Более того, трипсин также действует на другие проэнзимы такие, как химотрипсиноген, проэластаза и прокарбоксипептидазы А и В (рис. 3.2). Поскольку трипсин играет роль общего мощного активатора панкреатических пищеварительных ферментов, в соке поджелудочной железы присутствует низкомолекулярный пептид,
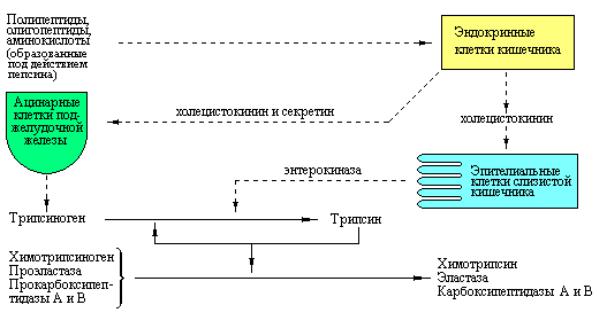
действующий как ингибитор трипсина и предотвращающий преждевременную активацию тех незначительных количеств трипсина, которые могут оказаться в клетках поджелудочной железы или ее протоках.
Рис. 3.2 Схема, иллюстрирующая последовательность стадий секреции и активации панкреатических ферментов.
Субстратная специфичность трипсина, химотрипсина и эластазы – основных панкреатических эндопептидаз – указана в табл. 3.1. Панкреатические протеолитические ферменты активны только при значениях рН, близких к нейтральному, поэтому эффективность их каталитического действия зависит, как было указано выше, от секреции бикарбоната, нейтрализующего соляную кислоту желудочного сока. Перечисленные выше эндопептидазы относят к семейству сериновых протеиназ, содержащих в активных центрах специфический остаток серина (у химотрипсина это Ser-195), ответственный за протеолитическую активность ферментов. Характерной особенностью сериновых протеиназ является их способность необратимо ингибироваться при действии органических фторфосфатов, конкретнее, при взаимодействии остатка активного серина с диизопропилфторфосфатом (см. далее).
Полипептиды и олигопептиды, образованные в результате протеолиза под действием пепсина и панкреатических эндопептидаз, подвергаются дальнейшей деградации в просвете тонкого кишечника при участии карбоксипептидаз А и В. Эти белки являются металлоферментами, для проявления активности которых необходимо присутствие в активном центре атома Zn и, следовательно, механизм их действия должен отличаться от механизма катализа карбокси- и сериновых протеиназ.
В результате комбинированного действия панкреатических пептидаз образуются свободные аминокислоты и короткие пептиды, состоящие из 2-8 аминокислотных остатков. Пептиды, образующиеся на данной стадии переваривания пищевого белка, содержат до 60% аминного азота.
Участие пептидаз тонкого кишечника в расщеплении коротких пептидов
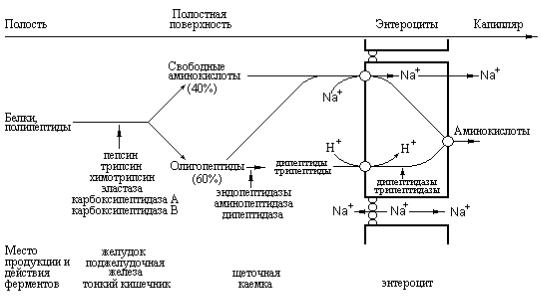
Поскольку секрет поджелудочной железы не содержит каких-либо заметных количеств аминопептидаз, окончательное переваривание олиго- и дипептидов зависит от функционирования ферментов щеточной каемки тонкого кишечника. Полостная поверхность плазматических мембран эпителиальных клеток кишечника особенно богата ферментами, проявляющими эндопептидазную и аминопептидазную активности, а также содержит дипептидазы с различной субстратной специфичностью. Конечными продуктами процесса пристеночного пищеварения являются свободные аминокислоты, ди- и трипептиды. Аминокислоты и короткие пептиды способны всасываться эпителиальными клетками при помощи специфических транспортных систем. Поступающие в энтероциты ди- и трипептиды гидролизуются в цитоплазме этих клеток до аминокислот и только после этого покидают клетки, направляясь в кровяное русло. Присутствие в цитоплазме эпителиальных клеток кишечника дипептидаз объясняет появление в воротной вене (после принятия пищи) практически только свободных аминокислот.
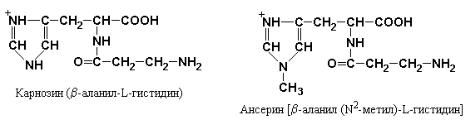
Фактическое отсутствие пептидов в крови ранее служило доказательством того, что при полостном пищеварении происходит полный гидролиз белков пищи до свободных аминокислот. Однако в настоящее время установлено, что большая часть аминного азота пищи всасывается в виде простейших пептидов, которые гидролизуются внутриклеточно. Исключение из этого общего правила составляют ди- и трипептиды, содержащие пролин или оксипролин, а также включающие необычные аминокислоты такие, как β-Аlа в карнозине (β-аланилгистидине) и ансерине [β-аланил (N2-метил) гистидине], присутствующие в мясе цыплят.
Дипептиды карнозин и ансерин являются «плохими» субстратами для дипептидаз цитоплазмы энтероцитов и поэтому транспортируются в неизмененном виде из эпителиальных клеток кишечника в кровяное русло.
Источник
единица 1 | 9.1. Роль белков в питании. Азотистый баланс 9.2. Переваривание белков в желудке и кишечнике, всасывание аминокислот 9.3. Трансаминирование и дезаминирование аминокислот |
Модульная единица 2 | 9.4. Обмен аммиака: источники, превращение в тканях 9.5. Орнитиновый цикл и его биологическая роль 9.6. Гипераммониемия и ее причины 9.7. Пути использования безазотистых остатков аминокислот 9.8. Биосинтез заменимых аминокислот |
Модульная единица 3 | 9.9. Обмен серина и глицина. Роль фолиевой кислоты 9.10. Обмен метионина. Реакции трансметилирования 9.11. Обмен фенилаланина, тирозина и гистидина в разных тканях 9.12. Заболевания, связанные с нарушением обмена фенилаланина и тирозина 9.13. Биогенные амины: синтез, инактивация, биологическая роль |
ЕМА 9.1. РОЛЬ БЕЛКОВ В ПИТАНИИ. АЗОТИСТЫЙ БАЛАНС
В организме человека содержится примерно 15 кг белков. Количество свободных аминокислот составляет около 35 г. Ежесуточно в организме распадается до аминокислот почти 400 г белков и столько же синтезируется.
1. Основным источником аминокислот для человека являются пищевые белки. Суточная норма потребления белков составляет в среднем около 100 г.
20 α-аминокислот, которые встречаются в белках организма, можно разделить на четыре группы:
• заменимые аминокислоты – Ала, Асп, Асн, Глу, Глн, Про, Гли, Сер – синтезируются в необходимых количествах в организме;
• незаменимые аминокислоты – Вал, Лей, Иле, Мет, Фен, Три, Лиз, Тре – не могут синтезироваться в организме и должны поступать с пищей;
• частично заменимые аминокислоты – Гис, Арг – синтезируются очень медленно, в количествах, не покрывающих потребности организма, особенно в детском возрасте;
• условно заменимые аминокислоты – Цис, Тир – синтезируются из незаменимых аминокислот Мет и Фен соответственно.
2. Полноценность белкового питания зависит от аминокислотного состава белков и определяется наличием незаменимых аминокислот.Отсутствие в пищевых белках незаменимых аминокислот (даже одной) нарушает их синтез в организме. Обновление белков в различных тканях происходит с разной скоростью. Так, белок соединительной ткани коллаген обновляется полностью за 300 дней, а белки системы свертывания крови – от нескольких минут до нескольких дней.
3. Большая часть свободных аминокислот используется для синтеза собственных белков организма. Кроме того, из аминокислот синтезируется большое количество биологически активных молекул:
• биогенные амины (медиаторы); некоторые аминокислоты сами являются нейромедиаторами – например, глицин и глутамат;
• гормоны белковой природы;
• гем, креатин, карнитин и другие азотсодержащие соединения.
Аминокислоты подвергаются реакции дезаминирования; образовавшиеся безазотистые остатки используются для синтеза глюкозы, кетоновых тел или окисляются до СО2 и Н2О.
Азот аминокислот выводится из организма почками в виде мочевины или аммонийных солей. Аминокислоты и белки содержат до 95% всего азота организма.
4. Азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством азота, выделяемого почками в виде мочевины и азотистых солей. Он является показателем состояния белкового и аминокислотного обмена.
Азотистый баланс может быть:
• положительным – у детей, беременных женщин, при увеличении мышечной массы у спортсменов и больных, выздоравливающих после тяжелой болезни, что свидетельствует о преобладании синтеза белков и роста тканей над их распадом;
• отрицательным – при тяжелых заболеваниях, голодании, старении, что свидетельствует об усилении процессов распада белков;
• равным нулю (азотистое равновесие) – у здоровых взрослых людей при нормальном питании.
1. При переваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонком кишечнике под действием ферментов пептидгидролаз (пептидаз). Основные пептидазы синтезируются в клетках желудка, поджелудочной железы и кишечника (рис. 9.1). В желудке белки пищи денатурируются и гидролизуются с образованием олигопептидов. Вкишечнике панкреатические пептидазы продолжают гидролиз олигопептидов до ди- и трипептидов и свободных аминокислот. Короткие пептиды расщепляются до свободных аминокислот в пристеночном слое или в клетках кишечного эпителия. Затем происходит их всасывание.
Все пептидазы, в зависимости от места расположения в пептиде гидролизуемой связи, делятся на эндопептидазы и экзопептидазы:
• эндопептидазы – расщепляют пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза);
• экзопептидазы – гидролизуют пептидные связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидазы А и В), а также расщепляют ди- и трипептиды.
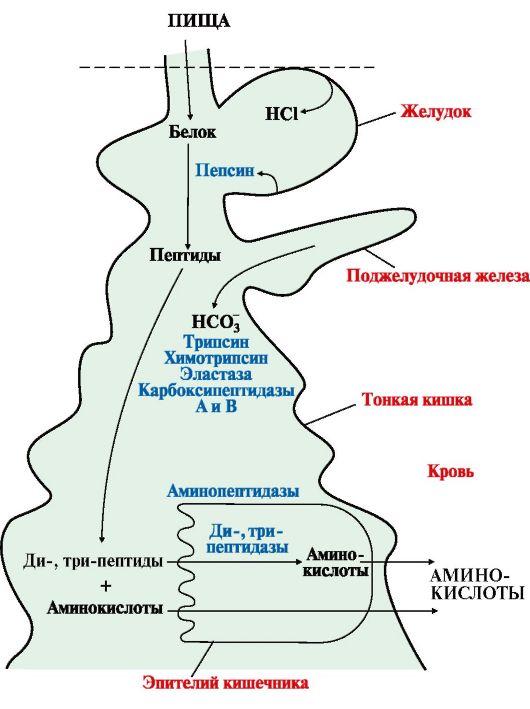 Рис. 9.1. Переваривание белков в желудочно-кишечном тракте
Рис. 9.1. Переваривание белков в желудочно-кишечном тракте
Ферменты, участвующие в переваривании белков, обладают относительной субстратной специфичностью и гидролизуют пептидные связи; при этом каждая пептидаза преимущественно расщепляет связи, образованные определенными аминокислотами (табл. 9.1).
2. Желудочные и панкреатические пептидазы вырабатываются в неактивной форме (проферменты), секретируются к месту действия, где активируются путем частичного протеолиза (отщепление пептида различной длины, чаще с N-конца молекулы профермента). Место синтеза проферментов (клетки слизистой оболочки желудка, поджелудочная железа) и место их активации (полость желудка, тонкого кишечника)пространственно разделены. Такой механизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
Таблица 9.1. Характеристика протеолитических ферментов желудочно-кишечного тракта
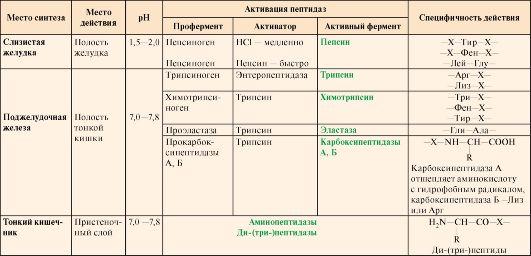 Примечание: X – любая аминокислота
Примечание: X – любая аминокислота
Преждевременная активация проферментов в секреторных клетках происходит при:
• язвенной болезни желудка – пепсиноген превращается в пепсин в клетках слизистой желудка;
• остром панкреатите – трипсиноген превращается в трипсин в клетках поджелудочной железы и активирует остальные панкреатические пептидазы.
3. Слизистая оболочка желудка вырабатывает следующие факторы, необходимые для переваривания белков:
• пепсиноген – синтезируется в главных клетках;
• соляную кислоту – вырабатывается обкладочными клетками. Гидролиз белков в желудке происходит под действием пепсина.
Профермент пепсиноген при поступлении пищи секретируется в полость желудка, где в два этапа происходит его активация:
• с помощью НС! – медленно;
• аутокаталитически – быстро, уже имеющимся пепсином. Соляная кислота желудочного сока выполняет следующие функции:
• .участвует в активации пепсиногена;
• создает оптимум рН для пепсина;
• оказывает бактерицидное действие;
• денатурирует белки пищи.
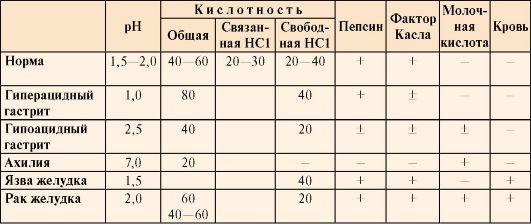
Значение рН желудочного сока в норме составляет 1,5-2,0. Определение кислотности желудочного сока используется для диагностики различных заболеваний желудка (табл. 9.2).
Таблица 9.2. Компоненты желудочного сока в норме и при патологических состояниях
•  Общая кислотность желудочного сока – это совокупность всех кислотореагирующих веществ желудочного сока, представляющая собой секрет желудка, собираемый в течение 1 часа (предварительно отбирают секрет, ранее содержащийся в желудке).
Общая кислотность желудочного сока – это совокупность всех кислотореагирующих веществ желудочного сока, представляющая собой секрет желудка, собираемый в течение 1 часа (предварительно отбирают секрет, ранее содержащийся в желудке).
• Связанная соляная кислота – это соляная кислота, связанная с белками и продуктами их переваривания.
• Свободная соляная кислота – это соляная кислота, не связанная с другими молекулами.
• Общая кислотность желудочного сока выражается в титрационных единицах (ТЕ) и измеряется количеством 0,1 М NaOH в миллилитрах, затраченным на титрование 100 мл желудочного сока в присутствии определенных индикаторов.
• Кислотность желудочного сока в норме составляет:
общая 40-60 ТЕ;
связанная HCl 20-30 ТЕ;
свободная HCl 20-40 ТЕ.
При диагностике заболеваний желудка помимо биохимических анализов обязательно проводят рентгенологические и эндоскопические исследования, иногда биопсию.
В слизистой оболочке желудка вырабатывается также внутренний фактор (фактор Касла), который представляет собой белок, способствующий всасыванию витамина В12 в тонкой кишке. Отсутствие этого витамина часто приводит к развитию анемии.
Молочная кислота в норме в желудочном соке отсутствует. Образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате усиленного размножения молочнокислых бактерий или при злокачественных опухолях желудка.
НС1 и пепсин способны разрушать клетки эпителия желудка. В норме это не происходит благодаря наличию защитных факторов слизистой оболочки, таких, как:
• образование на поверхности слизи, содержащей гетерополисахариды, которые не являются субстратами пептидгидролаз;
• секреция эпителиальными клетками ионов НСО3-, создающих в пристеночном слое менее агрессивную среду с рН 5,0-6,0, в которой пепсин неактивен. Кроме того, клетки поврежденного эпителия обладают способностью к быстрой регенерации.
Пепсин гидролизует пептидные связи, образованные аминогруппой или карбоксильной группой ароматических аминокислот (см. табл. 9.1):
4. Переваривание белков в кишечнике происходит под действием:
• ферментов поджелудочной железы-трипсина, химотрипсина, эластазы, карбоксипептидаз А и Б;
• ферментов эпителия тонкой кишки – аминопептидазы, дипептидаз, трипептидаз.
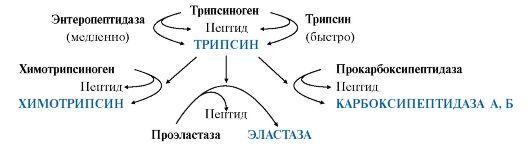
Активная форма трипсина образуется в кишечнике при участии фермента энтеропептидазы, выделяемого клетками кишечника. Энтеропептидазаотщепляет от N-конца трипсиногена гексапептид (рис. 9.2), что приводит к изменению конформации молекулы и формированию активного центра трипсина.
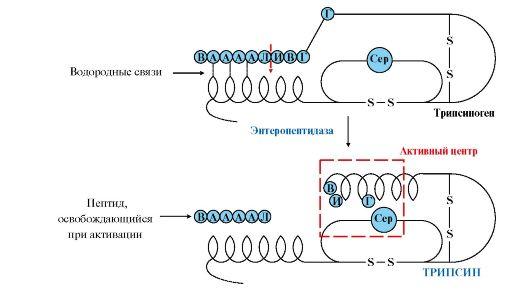 Рис. 9.2. Механизм активации трипсиногена.
Рис. 9.2. Механизм активации трипсиногена.
Пунктирная стрелка – место гидролиза. Буквами обозначены аминокислоты (А – асп, Г – глу, В – вал, Л – лиз, И – иле)
Остальные проферменты панкреатического сока (химотрипсиноген, прокарбоксипептидазы А и В, проэластаза) активируются трипсином.Активация панкреатических пептидаз в кишечнике происходит в виде каскада реакций.
 Ферменты эпителия тонкой кишки синтезируются в энтероцитах сразу в активной форме.
Ферменты эпителия тонкой кишки синтезируются в энтероцитах сразу в активной форме.
• Ферменты, участвующие в переваривании белков в кишечнике, обладают субстратной специфичностью к определенным аминокислотам в белке: Трипсин гидролизует преимущественно пептидные связи, образованные карбоксильными группами катионогенных аминокислот:
• 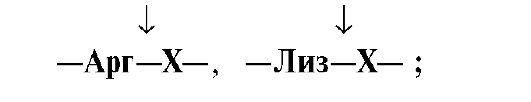 Химотрипсин – пептидные связи, образованные карбоксильными группами ароматических аминокислот:
Химотрипсин – пептидные связи, образованные карбоксильными группами ароматических аминокислот:
• Эластаза – связь между -Гли-Ала-
• Карбоксипептидазы отщепляют С-концевые аминокислоты:
карбоксипептидаза А – гидрофобные аминокислоты, карбоксипептидаза В – Лиз и Арг;
• Аминопептидаза – отщепляет N-концевые аминокислоты;
• Дипептидаза – гидролизует дипептиды;
• Трипептидаза – расщепляет трипептиды на отдельные аминокислоты.
5. Конечным результатом переваривания белков является образование свободных аминокислот, поступающих в клетки слизистой оболочки кишечника, путем вторично-активного транспорта за счет градиента концентрации натрия (симпорт). Всасывание L-аминокислот является активным, требующим затраты энергии процессом. Транспорт их осуществляется двумя путями:
• через воротную систему печени;
• по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток.
Аминокислоты конкурируют друг с другом за специфические участки связывания белков-переносчиков. Так, всасывание лейцина в больших количествах уменьшает всасывание изолейцина и валина. В крови максимальная концентрация аминокислот достигается через 30-50 минут после приема белковой пищи. Свободные аминокислоты, в отличие от белков пищи, лишены видовой специфичности и не обладают антигенными свойствами.
Скорость проникновения аминокислот через мембраны клеток различается, что указывает на существование транспортных систем, обеспечивающих перенос аминокислот через мембраны. Известно пять специфических транспортных систем для переноса определенной группы близких по строению аминокислот:
• нейтральных с короткой боковой цепью (аланин, серин, треонин);
• нейтральных с длинной или разветвленной боковой цепью (валин, лейцин, изолейцин);
• с катионными радикалами (лизин, аргинин);
• с анионными радикалами (глутаминовая и аспарагиновая кислоты);
• иминокислот (пролин, оксипролин).
Переносчики аминокислот первой и пятой групп, а также переносчик метионина относятся к числу Na+-зависимых. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин).
Одной из основных транспортных систем для нейтральных аминокислот является γ-глутамильный цикл, который функционирует в почках, поджелудочной железе, печени и селезенке, в мозге и других тканях он содержится в очень небольших количествах (рис. 9.3).
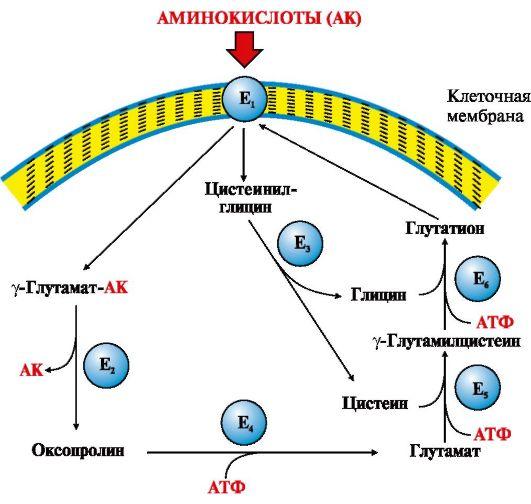 Рис. 9.3. γ-Глутамильный цикл:
Рис. 9.3. γ-Глутамильный цикл:
Е1 – γ-глутамилтранспептидаза (γ-ГТ); Е2 – γ-глутамилциклотрансфераза; Е3 – пептидаза; Е4 – оксопролиназа; Е5 – γ-глутамилцистеинсинтетаза; Е6 – глутатионсинтетаза.
Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием фермента γ-ГТ. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты
Ключевую роль в работе системы играет мембранный фермент γ-глутамилтранспептидаза (γ-ГТ). Этот гликопротеин катализирует перенос γ-глутамильной группы с глутатиона (γ-глутамилцистеинилглицин) или другого γ-глутамильного пептида на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион содержится во всех тканях животных. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачивается три молекулы АТР.
γ-ГТ в больших количествах содержится в почках, поджелудочной железе, печени и других тканях. Активность фермента в сыворотке крови в норме составляет 30-50 МЕ/л (мкмоль/мин-мг) для мужчин и 25-35 МЕ/л для женщин. Определение активности γ-ГТ в сыворотке крови используется для диагностики заболеваний печени и сердца. γ-ГТ-тест используется также в качестве маркера рака поджелудочной железы, печени, предстательной железы и для обнаружения людей из группы раннего риска алкоголизма, для контроля за лечением хронического алкоголизма.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
