Желудок в плевральной полости
Одной из нерешенных проблем неотложной хирургии остается ранняя диагностика и лечение грыж диафрагмы. Это обусловлено высоким риском развития тяжелых осложнений, связанных в силу разницы давления в грудной и брюшной полостях с неминуемым ущемлением различных органов живота в дефекте диафрагмы. Между тем число больных с грыжами диафрагмы с каждым годом увеличивается, что является следствием роста числа пострадавших с открытой и закрытой травмами груди и живота. Актуальность этой проблеме придает и то, что около 98% больных являются людьми трудоспособного возраста. Причиной развития травматических грыж диафрагмы практически всегда служит нераспознанное на предыдущем этапе лечения повреждение диафрагмы. В большинстве случаев грыжи развиваются вследствие открытых ранений (огнестрельных, колото-резаных), реже – закрытой травмы – сдавления груди или живота между жесткими плоскостями, падения с высоты и дорожно-транспортных происшествий [1-3]. При наиболее часто встречающихся ложных посттравматических диафрагмальных грыжах ворота чаще всего локализуются на левом куполе диафрагмы. Значительная редкость правосторонних посттравматических грыж грудобрюшной преграды обусловлена защитным действием печени [4-6].
Размеры грыжевых ворот при травматической диафрагмальной грыже могут быть различными: от небольшого отверстия, пропускающего один палец, до дефекта, охватывающего весь купол диафрагмы. Особенно широкими грыжевые ворота бывают при отрыве диафрагмы от грудной стенки и разрыве купола диафрагмы. Смещенной в плевральную полость чаще всего оказывается поперечная ободочная кишка, нередко вместе с желудком, иногда с селезенкой и другими органами. Помимо возникновения спаек с диафрагмой в области грыжевых ворот, выпавшие в дефект органы часто образуют прочное сращение грыжевого содержимого с легким, реберной или медиастинальной плеврой [7, 8].
За счет повышения качества диагностики в последние годы увеличилась частота выявления околопищеводных грыж и грыж естественных щелей диафрагмы. Характерная черта грыж диафрагмы – высокая склонность к развитию ущемления выпавших в плевральную полость органов с развитием тяжелых осложнений. Поэтому своевременное выявление этих грыж и их хирургическое лечение остаются актуальной задачей [9].
За 1995-2011 гг. под нашим наблюдением находились 79 больных в возрасте 23-72 лет с неущемленными грыжами диафрагмы. Посттравматическая грыжа выявлена у 45 больных, грыжа естественных щелей диафрагмы – у 10, параэзофагеальная грыжа – у 24. Из 45 больных с посттравматическими грыжами были 44 мужчины и одна женщина. Грыжа правого купола диафрагмы имелась у 8 пациентов, левого – у 37. Из 10 больных с грыжами естественных щелей были 9 мужчин и одна женщина. Грыжа Бохдалека справа выявлена у 1, Морганьи – у 6, Ларрея – у 3 больных. Из 24 больных с параэзофагеальными грыжами были 5 мужчин и 19 женщин. 97,5% больных были моложе 55 лет.
Все симптомы грыжи подразделяются на гастроинтестинальные, связанные с нарушением деятельности перемещенных органов брюшной полости, и кардиореспираторные, зависящие от сдавления легких или смещения средостения. Нередко больные жалуются на кишечные шумы в соответствующей половине грудной клетки, чувство распирания после еды, дисфагию, обильную отрыжку при перемене положения тела, приносящем облегчение. В случае выпадения в плевральную полость петель тонкой или ободочной кишки пациенты жалуются на внезапно развивающееся вздутие живота, схваткообразные боли в животе, задержку стула и газов.
При значительных дефектах диафрагмы и перемещении в плевральную полость большого объема органов функциональные и патоморфологические изменения развиваются также и в органах грудной полости. В длительно ателектазированном легком нередко возникает фиброз паренхимы, и оно теряет способность к полному расправлению после устранения грыжи. Нередко наблюдающееся при этом смещение органов средостения в здоровую сторону ведет к расстройству гемодинамики, так как при повороте смещенного сердца перегибаются впадающие в него полые вены. Пациенты жалуются на развитие чувства удушья и одышки после еды или вздутие живота, нередко сопровождающиеся нарушением ритма сердца.
В большинстве случаев неущемленные посттравматические диафрагмальные грыжи выявляются случайно, при профилактической флюорографии органов грудной клетки. По нашим данным, чувствительность лучевых методов исследования при диагностике посттравматических и параэзофагеальных грыж высока и составила 92%. Однако на амбулаторном этапе диагноз был установлен только у 23 из 45 больных.
Рентгенографию органов грудной клетки мы выполняли всем пациентам. При изолированном выпадении желудка над диафрагмой обычно определяется один большой газовый пузырь с горизонтальным уровнем жидкости. Введение зонда в желудок, прием во время исследования газированной жидкости или контрастного вещества позволяют уточнить природу газового пузыря и диагностировать выпадение желудка в плевральную полость. Кроме того, характерны подъем горизонтального уровня после приема пищи или воды и снижение его натощак, а также после введения зонда и откачивания содержимого. Выпадение петли ободочной кишки лучше всего может быть подтверждено при ирригоскопии.
По результатам исследования при обзорной рентгеноскопии газовый пузырь в плевральной полости был выявлен у 43% больных, в заднем средостении – у 11,4%. У 26,6% пациентов в плевральной полости определялись петли кишки с характерными гаустрациями. Контур диафрагмы был смазан у 16,5% пациентов, смещение органов средостения выявлено у 8,9%. В одном случае в левом реберно-диафрагмальном синусе обнаружена овальная тень с четкими контурами (оказалась селезенкой).
Контрастные исследования желудочно-кишечного тракта выполнены у 36 больных, в том числе рентгеноскопия желудка и двенадцатиперстной кишки – у 21, ирригоскопия – у 15. Перемещение желудка в заднее средостение выявлено у 81% обследованных больных. У 6 больных в заднем средостении располагалось дно желудка, у 8 – дно и тело желудка, у 3 желудок был перевернут вокруг поперечной оси спереди назад, и в заднем средостении располагались антральный отдел и часть тела желудка. Чувствительность контрастных методов исследования при перемещении полых органов достигала 100%.
Чувствительность УЗИ при диагностике неущемленных диафрагмальных грыж составила 33%. При УЗИ живота кроме нечеткости купола диафрагмы другие признаки диафрагмальных грыж выявить не удалось. Только при перемещении в плевральную полость значительного объема полых органов УЗИ позволяло квалифицировать находку как диафрагмальную грыжу. Транслокация селезенки в одном случае была идентифицирована сразу.
Спиральная компьютерная томография выполнена 43 больным. Всегда удавалось выявить в плевральной полости перемещенные сальник или полые органы, независимо от характера локализации грыжи. Наличие связи с органами брюшной полости, выявляемое особенно четко в фазе контрастирования, не оставляло сомнений о природе образования. Визуализировать непосредственно дефект диафрагмы удалось только у 9,3% больных. Чувствительность метода составила 100%.
Из 45 больных с посттравматическими грыжами диафрагмы у 27 в анамнезе было проникающее колото-резаное ранение груди, у 16 – закрытая травма груди и/или живота с развитием гемоторакса (у 13); 2 больных не смогли припомнить наличия травмы груди или живота. Всем 43 больным, в связи с наличием гемоторакса выполнено дренирование плевральной полости во втором межреберье в разных лечебных учреждениях в сроки от 3 мес до 6 лет назад. У всех этих больных повреждение диафрагмы оказалось не диагностированным, что привело к развитию диафрагмальной грыжи. Основной причиной этого явилась трудность диагностики повреждения диафрагмы, в том числе при применении современных высокотехнологических инструментальных методов исследования. В настоящее время единственно возможным способом ранней диагностики повреждений диафрагмы и, следовательно, профилактики развития диафрагмальных грыж является выполнение торакоскопии у всех больных при наличии гемоторакса (в отсутствие показаний к срочной торакотомии).
Лапароскопия была выполнена 54 больным, торакоскопия – 30 (в том числе 25 последовательно с лапароскопией и 5 – как единственное вмешательство). При выполнении эндовидеохирургического доступа диагностические задачи оказались нерешенными только у 5 пациентов. Чаще подобные ситуации возникают при изолированном пролабировании сальника в плевральную полость, особенно через естественные щели диафрагмы. В остальных случаях вмешательство носило лечебный характер с целью устранения диафрагмальных грыж. При выполнении лапароскопии диафрагмальная грыжа была визуализирована у всех пациентов, в том числе при параэзофагеальных грыжах. Торакоскопию выполняли после раздельной интубации бронхов трубкой Карленса или Робертшоу. Характер и локализация грыж, выявленная после полного клинико-инструментального обследования, представлена в табл. 1.
Спаечный процесс имелся во всех случаях посттравматических грыж, особенно выраженный между диафрагмой и базальными сегментами легкого, однако он редко служил препятствием для выполнения хирургического вмешательства. У 82,2% больных грыжа локализовалась в левом куполе диафрагмы. В отличие от параэзофагеальных грыж и грыж естественных щелей, при посттравматических грыжах грыжевой мешок, за редким исключением, отсутствует.
В последние годы малоинвазивные вмешательства занимают ведущие позиции при лечении этой патологии. Торакотомию и/или лапаротомию мы применяли только по очень узким показаниям (выраженный спаечный процесс в плевральной полости, очень большой дефект диафрагмы и необходимость субтотального или тотального протезирования диафрагмы, наличие противопоказаний к выполнению эндовидеохирургических вмешательств). Посредством только эндовидеохирургического доступа хирургические вмешательства выполнены у 74,7% больных. Еще в 2 случаях лапароскопия явилась этапом вмешательства. В зависимости от площади дефекта диафрагмы выполняли ушивание грыжевых ворот либо ее протезирование сеткой. Мы принципиально не применяли методики выкраивания П-образных лоскутов из диафрагмы для закрытия ее дефекта, поскольку при этом сокращается площадь диафрагмы и расстояние ее экскурсии, что может явиться причиной дыхательной недостаточности в раннем послеоперационном периоде. В этих случаях для закрытия дефекта использовали полипропиленовую сетку по принципу «ненатяжной» технологии, без ушивания стенок дефекта встык. Если со стороны плевральной полости необходимости в укрытии сетки нет, то со стороны брюшной полости оставление неукрытой сетки способствует развитию мощного спаечного процесса с вовлечением кишечных петель, с последующим развитием кишечных свищей и острой непроходимости кишечника. Поэтому мы укрывали сетку со стороны брюшной полости прядью большого сальника на «ножке», фиксируя ее по периметру дефекта герниостеплером или узловатыми швами. Характер хирургических вмешательств представлен в табл. 2.
Показанием к аллопластике грыжевых ворот считали дефекты эллипсовидной формы протяженностью более 7 см, округлой формы – размерами более 5×5 см, отрыв диафрагмы от грудной стенки протяженностью более 4 см. Летальных исходов не было. Осложнения наблюдались у 3 больных, в том числе гемоторакс – у 2, пневмоторакс – у 1. При гемотораксе у обоих больных выполнены повторная торакоскопия и санация плевральной полости. При пневмотораксе понадобилась активная аспирация воздуха в течение 5 дней, после чего легкое расправилось.
1. Основным способом профилактики посттравматических диафрагмальных грыж является выполнение торакоскопии при наличии гемоторакса при открытой и закрытой травмах груди и живота.
2. При неущемленных грыжах диафрагмы ведущими являются кардиореспираторные и гастроинтестинальные нарушения. Боли в груди, одышка, цианоз после еды или физической нагрузки отмечаются у 90% больных. Различные признаки нарушения пассажа содержимого по желудочно-кишечному тракту выявлены у 100% больных.
3. Посредством эндовидеохирургических технологий у 75% больных с грыжами диафрагмы удается выполнить радикальные хирургические вмешательства, что позволяет снизить тяжесть хирургической агрессии и сократить сроки медицинской и социальной реабилитации больных.
4. Применение полипропиленовой сетки для укрытия дефектов диафрагмы позволяет снизить частоту развития респираторных осложнений в раннем послеоперационном периоде.
Источник
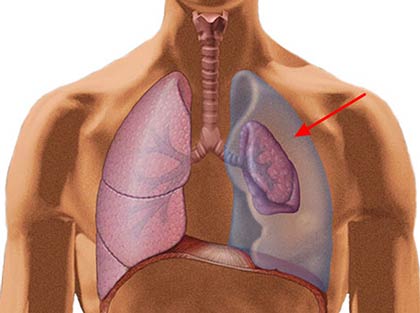
Жидкость в плевральной полости – состояние, которое на языке врачей обозначается специальным термином – гидроторакс. В большинстве случаев это результат экссудативного плеврита – воспаления в листках плевры. Гидроторакс может возникать при разных заболеваниях, в данной статье мы рассмотрим лишь то, что касается онкологии.
Плевра – что это такое?
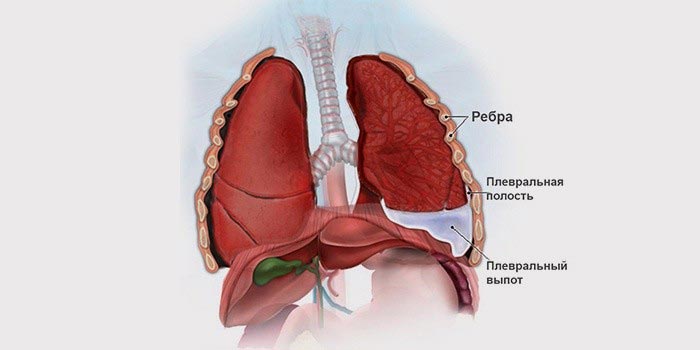
Плевра представляет собой тонкую пленку из соединительной ткани. Она обволакивает легкие и покрывает изнутри стенки грудной клетки. Соответственно, в плевре выделяют два листка: висцеральный и париетальный. Между ними находится узкая щель – плевральная полость. В норме в ней есть немного жидкости – примерно 10 мл. Эта жидкость работает как смазка: она уменьшает силу трения между легкими и стенками грудной клетки во время вдохов и выдохов.
При гидротораксе количество жидкости в плевральной полости увеличивается. Она сдавливает легкие, мешает им расправиться во время вдоха.
При каких типах рака возникает гидроторакс?
К скоплению жидкости в плевральной полости могут приводить разные виды злокачественных опухолей:
- рак легкого;
- рак молочной железы;
- ходжкинские и неходжкинские лимфомы;
- рак яичника;
- лейкемия;
- меланома;
- мезотелиома (злокачественная опухоль плевры);
- рак матки и ее шейки;
- рак желудка;
- саркомы.
Почему при онкологических заболеваниях в плевральной полости скапливается жидкость?
Плевральная жидкость постоянно обновляется. Она образуется из жидкой части крови, которая просачивается сквозь стенки капилляров, а затем всасывается в лимфатическую систему. Эти два процесса происходят постоянно и находятся в динамическом равновесии.
При поражении листков плевры раковыми клетками проницаемость капилляров повышается, а отток лимфы затрудняется (особенно если поражены лимфатические узлы, которые находятся внутри грудной клетки). Таким образом, увеличивается продукция плевральной жидкости, а скорость ее оттока падает. Развивается гидроторакс. Ситуация усугубляется при сердечной недостаточности, нарушении функции печени, почек.

Какими симптомами проявляется экссудативный плеврит и гидроторакс?
Симптомы экссудативного плеврита нарастают постепенно, по мере того, как в плевральной полости скапливается все больше жидкости. Возникает одышка, поначалу только во время интенсивных физических нагрузок, но со временем начинает беспокоить и при выполнении повседневных дел, ходьбе, в покое. Больной начинает быстрее уставать, часто просыпается по ночам. Зачастую одышка усиливается в положении лежа, а когда человек стоит, сидит – ему становится лучше.
Левая и правая части плевральной полости отделены друг от друга, чаще всего жидкость скапливается лишь с одной стороны. Таким больным часто становится легче, когда они лежат на больной стороне, так как при этом здоровое легкое лучше расправляется. Во время осмотра можно заметить, как пораженная половина грудной клетки «отстает» во время дыхания. Реже экссудативный плеврит носит двусторонний характер.
Постепенно начинает беспокоить чувство тяжести, боли в груди. Возникает упорный кашель. Обычно он сухой, иногда отходит немного мокроты. Больной становится бледным, постоянно чувствует слабость. Постоянно кажется, что «не хватает воздуха», что легкие расправляются во время вдохов не полностью. Многие больные испытывают страх, боятся задохнуться.
Диагностика плеврита и гидроторакса
Врач может выявить признаки скопления жидкости в плевральной полости уже на этапе осмотра. Во время приема доктор просит пациента раздеться выше пояса, осматривает грудную клетку, ощупывает, выстукивает ее, выслушивает с помощью фонендоскопа.
Диагноз помогают подтвердить следующие исследования:
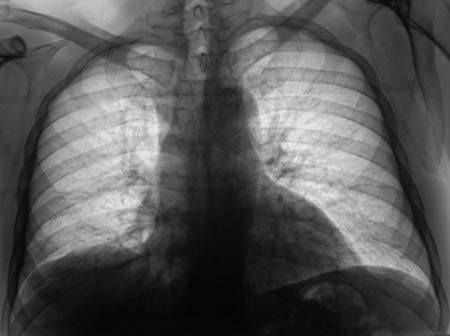
- Рентгенография. На снимках хорошо видна жидкость в плевральной полости и ее верхний уровень. Если гидроторакс связан с онкологическим заболеванием, рентгенография помогает обнаружить пораженные раком лимфатические узлы.
- Компьютерная томография позволяет получить более подробную информацию, обнаружить небольшое количество жидкости, выявить опухоль, метастазы в лимфатических узлах.
- Плевроцентез. Это одновременно и лечебная, и диагностическая процедура. Ее проводят, если в плевральной полости скопилось очень много жидкости, из-за этого нарушена функция легких, состояние угрожает жизни пациента. В стенке грудной клетки делают прокол, и из плевральной полости удаляют как можно больший объем жидкости. Некоторое ее количество отправляют на анализ в лабораторию.
- Диагностическая плевральная пункция. Ее проводят в случаях, когда в плевральной полости мало жидкости, и это не угрожает жизни пациента.
- Видеоторакоскопия. Этот метод диагностики применяют в случаях, когда после обследования у врача все еще остаются сомнения по поводу диагноза. В грудную клетку вводят торакоскоп – специальный эндоскопический инструмент с миниатюрной видеокамерой – и осматривают ее изнутри. Обнаружив подозрительные образования, врач может провести биопсию.
Методы лечения плеврита при онкологических заболеваниях
Если в плевральной полости находится много жидкости, и ее нужно срочно удалить, проводят плевроцентез (торакоцентез). Под местной анестезией в межреберном промежутке вводят специальную иглу и выводят через нее экссудат. После этого в плевральной полости может быть оставлен катетер для постоянного оттока жидкости. Наружный конец катетера соединяют со специальным мешком.
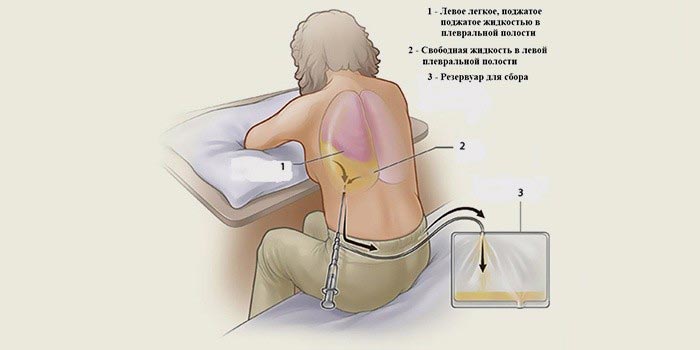
Плевроцентез проводят под контролем ультразвука. Процедура помогает временно улучшить состояние больного, но не решает основную проблему, не устраняет причину скопления жидкости в плевральной полости. Для этого требуются другие виды лечения.
Химиотерапия
Многим пациентам помогает системная химиотерапия. Примерно в 60% случаев плеврит, связанный с онкологическими заболеваниями, исчезает на фоне введения химиопрепаратов.
Плевродез
Если химиопрепараты неэффективны, и гидроторакс продолжает прогрессировать, несмотря на лечение, прибегают к плевродезу. В плевральную полость вводят препараты, которые вызывают склеивание листков плевры, в результате между ними исчезает пространство, в котором могла бы скапливаться жидкость.
Раньше с целью плевродеза в плевральную полость вводили тальк, доксициклин. В настоящее время эти препараты не применяют, потому что пациенты плохо их переносят и испытывают после процедуры боли. Современные врачи применяют химиопрепараты и иммунопрепараты. Это помогает убить двух зайцев: лекарство уничтожает раковые клетки и склеивает листки плевры, предотвращая скопление жидкости.
Из химиопрепаратов применяют: 5-фторурацил, этопозид, цисплатин, доксорубицин, блеомицин.
Плевродез с помощью иммунопрепаратов наиболее эффективен. С гидротораксом удается справиться в 90-94% случаев. Иммунопрепараты могут уничтожать опухолевые клетки, против которых бессильны химиопрепараты. Применяют рекомбинантный интерлейкин-2, LAK-клетки и их сочетание.
Для контроля эффективности лечения врач оценивает состояние пациента, изменение объема жидкости в плевральной полости, результаты ее цитологического анализа. Цитологическое исследование обычно проводят трижды: до начала лечения, примерно в его середине и по завершении.
Источник
