Железы желудка вырабатывающие пепсиноген
желудочные железы расположены в разных областях желудка . Это фундальные железы , сердечные железы и пилорические железы . Железы и желудочные ямки расположены в слизистой оболочке желудка . Сами железы находятся в lamina propria слизистой оболочки и открываются в основания желудочных ямок, образованных эпителием. Различные клетки желез секретируют слизь , пепсиноген , соляную кислоту , внутренний фактор , гастрин и бикарбонат .
Типы железы
Все три типа желез расположены под ямками внутри слизистой оболочки желудка – слизистой оболочки желудка. Слизистая оболочка желудка изрезана бесчисленными желудочными ямками, каждая из которых содержит 3-5 желудочных желез.
сердечные железы находятся в кардиальной области желудка, которая является часть, ближайшая к сердцу, охватывающая отверстие, где пищевод соединяется с желудком. Здесь находятся только сердечные железы, выделяющие в первую очередь слизь. Их меньше, чем других желез желудка, и они расположены неглубоко в слизистой оболочке. Есть два вида: простые трубчатые с короткими протоками или сложные кистевидные , напоминающие дуоденальные железы Бруннера .
фундальные железы (или кислородные железы), находятся на глазном дне и теле желудка. Это простые почти прямые трубы, две или более из которых выходят в один канал. Oxyntic означает секретирование кислоты, и они секретируют соляную кислоту (HCl) и внутренний фактор .
пилорические железы расположены в антральном отделе привратник . Они секретируют гастрин , продуцируемый их G-клетками .
Типы клеток
Поперечный разрез фундальной железы
Диаграмма, изображающая основные детерминанты секреции желудочного сока
В слизистой оболочке желудка находятся миллионы желудочных ям , и их необходимая узость определяет трубчатую форму желудочной железы. Более чем одна пробирка позволяет разместить более одного типа клеток. Форма каждой желудочной железы похожа; все они описаны как имеющие область шеи, которая находится ближе всего ко входу в ямку, и базальные области на нижних частях трубок. Эпителий слизистой оболочки желудка попадает в ямку, и на шейке эпителиальные клетки превращаются в короткие столбчатые зернистые клетки. Эти клетки почти заполняют трубку, а оставшийся просвет продолжается как очень тонкий канал.
Клетки, обнаруженные в железах желудка, включают фовеолярные клетки , главные клетки , париетальные клетки , G-клетки и энтерохромафиноподобные клетки (ECL). Первыми клетками всех желез являются фовеолярные клетки в области шеи, также называемые клетками слизистой шеи, которые производят слизь. Считается, что это отличается от слизи, производимой слизистой оболочкой желудка.
Фундальные железы, обнаруженные на глазном дне, а также в организме, имеют еще два типа клеток – желудочные главные клетки и париетальные клетки (оксинтические)).
главные клетки обнаруживаются в базальных областях железы и выделяют зимоген – пепсиноген , предшественник пепсина. .
париетальные клетки («париетальные» означает «относящиеся к стене») находятся в стенках трубок. Париетальные клетки выделяют соляную кислоту – главный компонент кислоты желудочного сока . Он должен быть легко доступен для желудка в обильном количестве, и поэтому их секреторные сети тонких каналов, называемые canaliculi , из их положения в стенках, могут выступать и проникать во все области желудочной ямки. просвет. Другой важный секрет париетальных клеток – это внутренний фактор . Внутренний фактор – это гликопротеин , необходимый для абсорбции витамина B12 .
Париетальные клетки также производят и выделяют ионы бикарбоната в ответ на высвобождение гистамина . из ближайших ECL, и поэтому они играют решающую роль в pHбуферной системе .
энтерохромаффиноподобные клетки накапливают и выделяют гистамин, когда pH желудка становится слишком высоким. Высвобождение гистамина стимулируется секрецией гастрина из G-клеток. Гистамин способствует выработке и высвобождению HCL из париетальных клеток в кровь и протонов в просвет желудка. Когда pH желудка снижается (становится более кислым), ECL перестают выделять гистамин.
G-клетки в основном обнаруживаются в пилорических железах антрального отдела пилоруса ; некоторые находятся в двенадцатиперстной кишке и других тканях. G-клетки секретируют гастрин. Ямки желудка этих желез намного глубже, чем другие, и здесь гастрин секретируется в кровоток, а не в просвет.
Клиническое значение
Полипоз фундальной железы – это медицинский синдром, при котором глазное дно и тело желудка развиваются многие фундальные железы полипы .
злокачественная анемия возникает, когда поврежденные париетальные клетки не могут производить внутренние фактор, необходимый для усвоения витамина B12. Это может быть одной из причин дефицита витамина B12 .
См. Также
- Синдром Золлингера-Эллисона
Дополнительные изображения
Слои стенки желудка
Регуляция желудочной кислоты
Ссылки
Эта статья включает текст из общественного достояния из 20-го издания Анатомии Грея (1918)
Внешние ссылки
- Изображение гистологии: 50_02 в Центре медицинских наук Университета Оклахомы – «Фундальный желудок»
- Фото анатомии: пищеварительная система / млекопитающее / желудок4 / желудок2 – Сравнительная органология в Калифорнийском университете в Дэвисе – «Млекопитающее, желудок жвачных животных (LM, High)»
- Изображение гистологии: 11301ooa – Система обучения гистологии в Бостонском университете – «Пищеварительная система: пищеварительный канал – фундальный желудок “
- Ветеринарная гистология в vt.edu
- MedEd в Лойоле Histo / frames / Histo18.htm l – см. слайд №42
- Гистологическое изображение: 100_04 в Центре медицинских наук Университета Оклахомы – «Соединение пищевода и желудка»
- Гистологическое изображение: 11103loa – Система обучения гистологии в Бостоне Университет – «Пищеварительная система: пищеварительный канал: соединение пищевода и желудка»
Источник
Пепсиноген I – это предшественник фермента пепсина, необходимого для переваривания белка. Он является индикатором повреждения слизистой оболочки тела желудка.
Синонимы русские
Пепсиноген 1.
Синонимы английские
Pepsinogen I, PGI, PgI.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
Мкг/л (микрограмм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь и жирную пищу за 24 часа до анализа.
- Не есть в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить 30 минут до сдачи крови.
Общая информация об исследовании
Пепсиноген – предшественник фермента пепсина, обеспечивающего начальный этап переваривания белков. Он вырабатывается клетками слизистой оболочки желудка как неактивный профермент, который под воздействием соляной кислоты превращается в активный пепсин. Различают два вида пепсиногена: пепсиноген I и пепсиноген II. Пепсиноген I образуется исключительно в главных клетках слизистой желудка, находящихся только в теле желудка. В норме в кровь выделяется небольшое количество пепсиногена I, которое может быть измерено при лабораторной диагностике.
Тело желудка является единственным отделом, где происходит синтез соляной кислоты и внутреннего фактора, необходимого для всасывания витамина B12. При заболеваниях, поражающих тело желудка, синтез пепсиногена I, соляной кислоты и внутреннего фактора значительно снижается. Так как изменение концентрации пепсиногена I наиболее точно отражает тяжесть и степень поражения тела желудка, этот клинико-лабораторный показатель используется при диагностике заболеваний тела желудка и наблюдении за их течением.
Самой частой причиной воспаления слизистой оболочки желудка является инфицирование грамотрицательной спиралевидной бактерией Helicobacter pylori (H. pylori). Она устойчива к воздействию соляной кислоты и поэтому способна колонизировать слизистую оболочку желудка. Эта бактерия выделяет цитотоксины и протеазы, которые постепенно разрушают слизистую желудка, что приводит к атрофическому гастриту. Он сначала поражает антральный и пилорический отдел, а затем и тело желудка. Атрофия может быть выражена в той или иной степени в разных отделах желудка, что дало основание для выделения форм атрофического гастрита: атрофический антральный гастрит, атрофический гастрит тела желудка и атрофический пангастрит. Необходимо отметить, что не у всех пациентов с атрофическим гастритом выявляется активная инфекция H. Pylori – это говорит о том, что данный микроорганизм – лишь одна из причин гастрита, который в дальнейшем поддерживается другими факторами (курением, употреблением алкоголя, регулярным применением нестероидных противовоспалительных препаратов). Только у половины пациентов, инфицированных H. pylori, в итоге возникает атрофический гастрит, что свидетельствует об индивидуальной восприимчивости к повреждающему воздействию этого микроорганизма.
В ответ на инфекцию H. pylori вырабатываются специфические антитела. Установлено, что некоторые антигены H. pylori имеют структурное сходство с антигенами основного фермента обкладочных клеток, синтезирующих соляную кислоту (H-K-ATPase). Этот феномен назван молекулярной мимикрией. Её результатом является то, что защитные антитела против H. pylori вступают в перекрёстную реакцию с антигенами собственных обкладочных клеток, что приводит к их гибели. Наличие аутоантител к обкладочным клеткам слизистой желудка – характерная особенность аутоиммунного атрофического гастрита. Считается, что он развивается на фоне длительно протекающей инфекции H. pylori у предрасположенных к нему лиц. Аутоиммунный гастрит часто сопровождается другими аутоиммунными заболеваниями: сахарным диабетом 1-го типа, витилиго и аутоиммунным тиреоидитом Хашимото.
Как правило, атрофический гастрит развивается медленно, без выраженных симптомов. Пациенты могут испытывать несильную боль в области эпигастрия, чувство быстрого насыщения и переполнения желудка, тошноту, слабость. Постепенное разрушение обкладочных клеток приводит к ахлоргидрии и дефициту внутреннего фактора. Соляная кислота необходима для нормального переваривания белка, высвобождения связанного с пищевым белком витамина В12, а также для окисления соединений кальция, железа, цинка и магния в формы, доступные для всасывания в двенадцатиперстной кишке. Ахлоргидрия приводит к нехватке витамина В12, которая может проявляться изменениями со стороны крови, желудочно-кишечного тракта и нервной системы. Возникающая при этом макроцитарная анемия сопровождается слабостью, головокружением и учащённым сердцебиением. Изменения желудочно-кишечного тракта вызывают нарушение переваривания и, соответственно, диарею. Особо опасны нарушения нервной системы: демиелинизация аксонов трактов спинного мозга необратима и может привести к параличу и нарушениям чувствительности.
Выраженная деструкция обкладочных клеток и ахлоргидрия наиболее характерны для аутоиммунного атрофического гастрита. При атрофическом гастрите тела желудка, а также при пангастрите вместе с обкладочными клетками гибнут и главные, что отражается в понижении концентрации пепсиногена I в крови, поэтому он является клинико-лабораторным индикатором повреждения тела желудка и используется в диагностике атрофического гастрита тела желудка и пангастрита. К тому же существует взаимосвязь между тяжестью атрофического гастрита и степенью снижения концентрации пепсиногена I крови. Благодаря этому тест на пепсиноген I может быть полезен на этапе контроля за эффективностью лечения атрофического гастрита после курса антибиотиков.
Соляная кислота обеспечивает естественную защиту против патогенных микроорганизмов. При ахлоргидрии этот барьер нарушен, что выражается большей уязвимостью перед кишечными инфекциями (в частности, лямблиозом и псевдомембранозным колитом).
Пациентам с гиперацидным гастритом, при котором секреция соляной кислоты повышена, часто назначаются ингибиторы протонной помпы (например, омепразол). Длительное подавление секреции соляной кислоты обкладочными клетками приводит к постепенной атрофии этих клеток. Поэтому тем, кто применяет блокаторы протонной помпы более 1 года, необходимо проверять уровень пепсиногена I для того, чтобы узнавать о необходимости продолжения лечения или его коррекции.
Атрофический гастрит – самый значимый фактор риска развития аденокарциномы желудка. Разрушение нормальных клеток слизистой оболочки желудка при нём сопровождается появлением очагов метаплазии. При метаплазии происходит замена желудочного эпителия на эпителий кишечного типа, гораздо менее устойчивый к воздействию соляной кислоты. Такие очаги метаплазии являются предраковыми состояниями: аденокарцинома желудка развивается у 2,5-5 % пациентов с атрофическим гастритом тяжёлой и средней тяжести, тяжёлый атрофический пангастрит связан с 90-кратным увеличением риска развития аденокарциномы. К факторам риска аденокарциномы желудка также относятся: употребление большого количества пищи, содержащей нитраты, копчёных продуктов, алкоголя, курение, инфицирование H. pylori, лучевая терапия, наследственность, а также наличие других предраковых состояний (желудочного полипа, болезни Менетрие). Как правило, пациенты с аденокарциномой желудка обращаются к врачу уже на поздней стадии, когда опухоль достигла крупных размеров и есть метастазы. Это связано с тем, что длительное время аденокарцинома сопровождается неспецифическими симптомами: слабостью, дискомфортом в области эпигастрия, потерей веса. Боль, рвота, желудочное кровотечение, асцит говорят уже о далеко зашедшем процессе. В связи с этим пациентам, входящим в группу риска по развитию аденокарциномы, необходимо регулярно обследоваться. Инвазивные процедуры (эндоскопия с биопсией участков атрофии/метаплазии) и радиологические методики (рентгенологическое исследование с контрастированием) не используются в качестве скрининга, так как могут вызвать осложнения. В этой ситуации анализ на пепсиноген I является удобным способом оценить состояние слизистой оболочки тела желудка.
Сочетание тестов на пепсиноген I, пепсиноген II, гастрин 17 и на активную инфекцию H. pylori позволяет точно охарактеризовать состояние с
Что означают результаты?
Референсные значения: 30 – 165 мкг/л.
Причины повышения уровня пепсиногена I:
- язва двенадцатиперстной кишки,
- инфицирование H. pylori,
- гастринома,
- хроническая почечная недостаточность,
- регулярное применение ингибиторов протонной помпы в течение короткого срока.
Причины понижения уровня пепсиногена I:
- атрофический гастрит тела желудка или пангастрит,
- пернициозная анемия,
- аденокарцинома и карциноид желудка,
- аутоиммунный тиреоидит, сахарный диабет I типа,
- ваготомия, резекция желудка,
- гипофункция аденогипофиза,
- регулярное применение ингибиторов протонной помпы в течение длительного срока (больше 1 года).
Что может влиять на результат?
Концентрация пепсиногена I повышается с возрастом и при хронической почечной недостаточности.
Важные замечания
Анализ на пепсиноген I следует производить в комплексе с тестами на другие показатели, отражающие состояние слизистой оболочки желудка (гастрин, пепсиноген II, антитела к H. pylori и антиген H. pylori).
Также рекомендуется
- Helicobacter pylori, IgG (количественно)
- Helicobacter pylori, ДНК [реал-тайм ПЦР]
- Helicobacter pylori, антиген
- Гастрин
- Пепсиноген II
Кто назначает исследование?
Врач общей практики, гастроэнтеролог, онколог.
Литература
- LARS AGRÉUS et al. Rationale in diagnosis and screening of atrophic gastritis with stomach-speci?c plasma biomarkers. Scandiian Journal of Gastroenterology. 2012; 47: 136-147.
- Edith Lahner, Bruno Annibale. Pernicious anemia: New insights from a gastroenterological point of view. World J Gastroenterol 2009 November 7; 15(41): 5121-5128.
- Chisato Hamashima et al. The Japanese Guidelines for Gastric Cancer Screening. Jpn J Clin Oncol 2008;38(4)259-267.
- AH Poulsen, S Christensen, JK McLaughlin. Proton pump inhibitors and risk of gastric cancer: a population-based cohort study. British Journal of Cancer (2009) 100, 1503 – 1507.
- Toshitatsu Takao et al. Multifaceted Assessment of Chronic Gastritis: A Study of Correlations between Serological, Endoscopic, and Histological Diagnostics. Gastroenterol Res Pract. 2011;2011:631461.
Источник
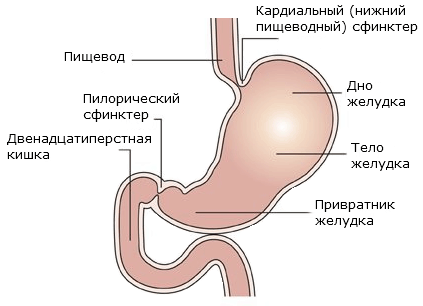
В желудке пища задерживается в среднем 4-6 часов для химической и механической обработки. В желудке выделяют 4 части: вход, или кардиальная часть, верхняя – дно (или свод), средняя наибольшая часть – тело желудка и нижняя, – антральная часть, занчивающаяся пилорическим сфинктером, или привратником, (отверстие привратника ведет в двенадцатиперстную кишку).

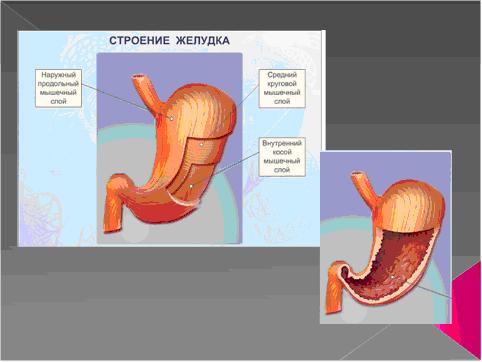
Стенка желудка состоит из трех слоев: наружного – серозного, среднего – мышечного и внутреннего – слизистого. Сокращения мышц желудка вызывают как волнообразные (перистальтические), так и маятникообразные движения, благодаря которым пища перемешивается и передвигается от входа к выходу из желудка. В слизистой оболочке желудка находятся многочисленные железы, вырабатывающие желудочный сок. Из желудка полупереваренная пищевая кашица (химус) поступает в кишечник. На месте перехода желудка в кишечник находится пилорический сфинктер, который при сокращении полностью отделяет полость желудка от двенадцатиперстной кишки. Слизистая оболочка желудка образует продольные, косые и поперечные складки, которые расправляются при заполнении желудка. Вне фазы пищеварения желудок находится в спавшемся состоянии. Через 45 – 90 минут периода покоя возникают периодические сокращения желудка, длящиеся 20 – 50 мин (голодная перистальтика). Вместимость желудка взрослого человека составляет от 1,5 до4 л.
Функции желудка:
1) депонирование пищи;
2) секреторная – выделение желудочного сока для переработки пищи;
3) двигательная – для передвижения и перемешивания пищи;
4) всасывание некоторых веществ в кровь (вода, алкоголь);
5) экскреторная – выделение в полость желудка вместе с желудочным соком некоторых метаболитов;
6) инкреторная – образование гормонов, регулирующих деятельность пищеварительных желез (например, гастрина);
7) защитная – бактерицидная (в кислой среде желудка погибает большинство микробов).
Состав и свойства желудочного сока.
Желудочный сок продуцируется желудочными железами, которые располагаются в области дна (свода) и тела желудка. Они содержат 3 типа клеток:
1) главные, которые вырабатывают комплекс протеолитических ферментов (пепсин А, гастриксин, пепсин В);
2) обкладочные, которые вырабатывают соляную кислоту;
3) добавочные, в которых вырабатывается слизь (муцин, или мукоид). Благодаря этой слизи, стенка желудка защищена от действия пепсина.
В состоянии покоя («натощак») из желудка человека можно извлечь примерно 20 – 50 мл желудочного сока, рН 5,0. Общее же количество желудочного сока, выделяющегося у человека при обычном питании, равно 1,5 – 2,5 л в сутки. рН активного желудочного сока составляет 0,8 – 1,5, т. к. в нем содержится примерно 0,5 % HCl.
Роль HCl. Повышает выделение пепсиногенов главными клетками, способствует переводу пепсиногенов в пепсины, создает оптимальную среду (рН) для деятельности протеаз (пепсинов), вызывает набухание и денатурацию белков пищи, что обеспечивает повышенное расщепление белков, а также способствует гибели микробов.
Фактор Кастла. В пище содержится витамин В12, необходимый для образования эритроцитов, так называемый внешний фактор Кастла. Но всосаться в кровь он может только при наличии в желудке внутреннего фактора Кастла. Это гастромукопротеин, в состав которого входит пептид, отщепляющийся от пепсиногена при его превращении в пепсин, и мукоид, выделяющийся добавочными клетками желудка. Когда секреторная деятельность желудка снижается, продукция фактора Кастла тоже снижается и соответственно уменьшается всасывание витамина В12, вследствие чего гастриты с пониженной секрецией желудочного сока, как правило, сопровождаются анемией.
Фазы желудочной секреции:
1. Сложнорефлекторная, или мозговая, длительностью 1,5 – 2 ч, которой секреция желудочного сока происходит под действием всех факторов, сопровождающих прием пищи. При этом условные рефлексы, возникающие на вид, запах пищи, обстановку, комбинируются с безусловными, возникающими при жевании и глотании. Сок, выделяющийся под влиянием вида и запаха пищи, жевания и глотания, называется «аппетитный» или «запальный». Он подготавливает желудок к приему пищи.
2. Желудочная, или нейрогуморальная, фаза, в которой стимулы секреции возникают в самом желудке: секреция усиливается при растяжении желудка (механическая стимуляция) и при действии на его слизистую экстрактивных веществ пищи и продуктов гидролиза белков (химическая стимуляция). Главным гормоном в активации желудочной секреции во второй фазе является гастрин. Выработка гастрина и гистамина также происходит под влиянием местных рефлексов метасимпатической нервной системы.
Гуморальная регуляция присоединяется через 40 – 50 минут после начала мозговой фазы. Кроме активирующего влияния гормонов гастрина и гистамина, активация выделения желудочного сока происходит под влиянием химических компонентов – экстрактивных веществ самой пищи, в первую очередь мяса, рыбы, овощей. При варке продуктов они переходят в отвары, бульоны, быстро всасываются в кровь и активируют деятельность пищеварительной системы. К таким веществам прежде всего относятся свободные аминокислоты, витамины, биостимуляторы, набор минеральных и органических солей. Жир вначале тормозит секрецию и замедляет эвакуацию химуса из желудка в двенадцатиперстную кишку, но затем он стимулирует деятельность пищеварительных желез. Поэтому при повышенной желудочной секреции не рекомендуются отвары, бульоны, капустный сок.
Наиболее сильно желудочная секреция повышается под влиянием белковой пищи и может продолжаться до 6-8 часов, слабее всего она изменяется под влиянием хлеба (не более 1 ч). При длительном нахождении человека на углеводном режиме питания кислотность и переваривающая сила желудочного сока снижаются.
3. Кишечная фаза. В кишечной фазе происходит угнетение секреции желудочного сока. Она развивается при переходе химуса из желудка в двенадцатиперстную кишку. При попадании кислого пищевого комка в двенадцатиперстной кишке начинают продуцироваться гормоны, гасящие желудочную секрецию, – секретин, холецистокинин и другие. Количество желудочного сока уменьшается на 90 %.
Источник
