Субтотальная резекция пищевода с одномоментной пластикой желудка

При кардиоэзофагеальном раке операцию начинают в брюшной полости. После сагиттальной диафрагмотомии и мобилизации абдоминального и ретроперикардиального сегментов пищевода определяют резектабельность опухоли.
Мобилизацию желудка и лимфаденэктомию выполняют так же, как было описано выше, но изоперистальтическую желудочную трубку формируют значительно большей длины. Большой сальник обязательно удаляют (рис. 130).
Пищевод пересекают выше опухоли с помощью сшивающего аппарата, оральный конец прошивают длинной крепкой нитью (рис. 131).

Рис. 130. Мобилизация желудка при кардиоэзофагеальном раке — линия отсечения большого сальника обозначена пунктиром.

Рис. 131. Пересечение пищевода при кардиоэзофагеальном раке (справа вверху — прошивание орального конца пишевода).
Сформированный изоперистальтический трансплантат привязывают к оральному концу пищевода. Устанавливают дренажи вдоль верхнего края поджелудочной железы и под левым куполом диафрагмы, лапаро-томную рану ушивают (рис. 132).

Рис. 132. Продолжение операции: фиксация сформированного желудочного трансплантата к оральному концу пищевода (справа вверху — схема дренирования брюшной полости).
После торакотомии выводят за нить в плевральную полость желудочный трансплантат. Выполняют дополнительную мобилизацию грудного отдела пищевода блоком с плеврой и медиастинальными лимфоузлами, тщательно лигируя все сращения и пищеводные сосуды. Пищевод отсекают по линии намеченной резекции (рис. 133).

Рис. 133. Выведение желудочного трансплантата в правую плевральную полость, дополнительная мобилизация грудного отдела пищевода, лимфаденэктомия из средостения (вверху — положение больного на операционном столе и хирургический доступ).
При необходимости диаметр верхнего конца желудочной трубки «подгоняют» к диаметру пищевода, резецируя конец трансплантата таким образом, чтобы со стороны его «малой кривизны» на протяжении 2,5— 3 см не было металлических скрепок. Верхнюю часть стебля ушивают вручную узловыми швами. Этот прием облегчает инвагинацию пищевода в желудочную трубку, которая оказывается несколько шире, чем анастомоз и пищевод. Кроме того, исключается присутствие ригидных металлических скрепок в зоне анастомоза, что также облегчает его формирование (рис. 134).

Рис. 134. Формирование верхнего конца желудочной трубки для внутриплеврального анастомоза с пищеводом (а—в). Объяснения в тексте.
Если стенка пищевода тонка и непрочна, лучше наложить однорядный анастомоз узловыми швами, которые сначала накладывают по всему периметру и берут на зажимы, а затем по очереди (начиная с задней стенки) затягивают (рис. 135). Полезно «подвесить» однорядный анастомоз для предупреждения его натяжения путем фиксации желудочной трубки к медиастинальной плевре (рис. 136).

Рис. 135. Начальный момент формирования однорядного эзофагогастроанастомоза в плевральной полости (вверху справа — схема проведения швов через стенки пищевода и желудочной трубки).

Рис. 136. Завершение однорядного эзофагогастроанастомоза — наложение «подвешивающих» швов.
При доброкачественных стриктурах удаление всей малой кривизны не обязательно, но тем не менее кардия и часть дна желудка должны быть резецированы как зоны с неудовлетворительным кровоснабжением (рис. 137). Необходимо отметить, что при пластике целым желудком надо всегда делать пилоромиотомию или пилоропластику из-за реальной опасности возникновения нарушений желудочной эвакуации в раннем послеоперационном периоде и в последующие сроки.

Рис. 137. Формирование желудочного трансплантата для внутриплевральной эзофагопластики при доброкачественных стриктурах пищевода (справа вверху — линия резекции кардии и дна желудка обозначена пунктиром).
После выведения желудочного трансплантата в плевральную полость пищевод анастомозйруют с его передней стенкой двухрядными узловыми швами. Сначала пищевод подшивают 6 швами (по 3 справа и слева) к передней стенке желудка, затем вскрывают просвет трансплантата поперечным разрезом и узловыми швами формируют заднюю губу анастомоза (рис. 138, а—в). В желудок через линию анастомоза вводят толстый зонд и формируют внутренний ряд швов на переднюю губу соустья. Затем накладывают три П-образных шва с подхватом на стенке пищевода медиастинальной плевры, зонд удаляют и затягивают П-образные швы. При этом пищевод инвагинируется в желудок, создается антирефлюксныи клапан по типу «чернильницы-непроливайки». Газовый пузырь желудка позади анастомоза усиливает клапанный эффект. Операцию заканчивают дренированием плевральной полости и введением назогастрального зонда, с помощью которого проводят постоянную аспирацию на протяжении 4—5 послеоперационных суток (профилактика гастростаза).

Рис. 138. Формирование двухрядного инвагинационного эзофагогастроанастомоза в плевральной полости при пластике целым желудком.
а — начальный момент операции (справа вверху — схема наложения швов заднего ряда).

Рис. 138. Продолжение.
б — формирование второго ряда П-образных швов на передней стенке пищеводно-желудочного анастомоза при пластике целым желудком (справа вверху — схема наложения швов переднего ряда).

Рис. 138. Продолжение.
в — завершение внутриплеврального эзофагогастроанастомоза при пластике целым желудком (вверху — схема анастомоза в сагиттальном разрезе и схема дренирования).
А.Ф. Черноусов, П.М. Богопольский, Ф.С. Курбанов
Опубликовал Константин Моканов
Источник
Рак пищевода — один из наиболее агрессивных типов злокачественных опухолей. Он занимает восьмое место среди причин смертности от онкологических заболеваний во всем мире. Прогноз напрямую зависит от ранней диагностики. Основной, наиболее радикальный метод лечения, который позволяет добиваться ремиссии — хирургическое удаление пораженной части органа.
Наш эксперт в этой сфере:
Торако-абдоминальный хирург, онколог, заведующий отделением хирургии
Позвонить врачу
Если рак пищевода диагностирован на самой ранней стадии, когда злокачественная опухоль находится в пределах слизистой оболочки и не прорастает глубже, пятилетняя выживаемость пациентов после операции составляет 85–100%. Она снижается до 20% при распространенном раке, если применяется только хирургическое лечение.
При выборе тактики лечения врач должен учитывать стадию рака пищевода, локализацию опухоли (противопоказание к радикальной операции — поражение шейного отдела пищевода), общее состояние здоровья пациента, его возраст, сопутствующие заболевания.
В клинике Медицина 24/7 решения о лечении пациентов со злокачественными опухолями пищевода принимаются на профессиональных врачебных консилиумах, в которые входят клинические онкологи, хирурги, химиотерапевты, радиотерапевты и другие специалисты.
Эндоскопическая хирургия при ранних стадиях рака пищевода
Если злокачественная опухоль пищевода диагностирована на самых ранних стадиях, можно выполнить эндоскопическую операцию без разрезов на коже. Такие вмешательства возможны при раке «на месте», опухолях, которые не прорастают за пределы слизистой оболочки (стадия T1 по классификации TNM), тяжелой дисплазии.
Врач-эндоскопист удаляет опухоль в пределах слизистой оболочки или подслизистого слоя и отправляет на гистологическое исследование. Важно оценить край резекции, то есть выяснить, есть ли опухолевые клетки возле линии разреза. Позитивный край резекции говорит о том, что новообразование могло быть удалено не полностью.
К сожалению, рак пищевода на таких ранних стадиях удается диагностировать очень редко. У многих пациентов на момент установления диагноза опухоль уже нерезектабельна.
Хирургическое лечение рака пищевода на стадиях I–IIA
Радикальная операция возможна у большинства пациентов при следующих стадиях рака пищевода:
- Стадия I: злокачественная опухоль прорастает до уровня собственной, мышечной пластинки слизистой оболочки или в подслизистый слой, не вторгается в мышечный слой стенки органа, нет очагов поражения в регионарных лимфатических узлах и отдаленных метастазов.
- Стадия IIA: опухоль прорастает в мышечный слой или в наружный слой (адвентицию).
Чаще всего выполняют трансторакальную субтотальную резекцию пищевода с внутриплевральной пластикой желудка или толстой кишкой с билатеральной двухзональной медиастинальной лимфодиссекцией из комбинированного лапаротомного и правостороннего торакотомного доступов.
При таком варианте хирургического вмешательства пораженный опухолью участок пищевода удаляют через разрезы на животе и груди:
- Если опухоль находится в нижней части пищевода или на границе с желудком, удаляют часть пищевода с захватом участка выше опухоли 8–10 см и часть желудка. Оставшуюся часть желудка соединяют с пищеводом.
- При опухолях в верхней части пищевода удаляют большой участок органа и подтягивают к его оставшейся верхней части желудок, накладывают анастомоз.
Если из-за большого дефекта не удается соединить пищевод с желудком, используют сегмент кишки.
При небольших опухолях на ранних стадиях резекция пищевода может быть выполнена малоинвазивным способом через проколы вместо разреза. Проколы выполняют в области груди и живота (торакоскопия + лапароскопия), возможны комбинированные вмешательства одновременно через разрез и прокол (торакотомия + лапароскопия или лапаротомия + торакоскопия). В некоторых клиниках проводят робот-ассистированные операции.
Удаленные во время операции ткани отправляют на биопсию. К негативным факторам прогноза после хирургического лечения относят:
- Низкую степень дифференцировки (G3 и выше). При этом опухолевые клетки практически полностью утрачивают черты нормальных. Такой рак ведет себя более агрессивно, склонен к быстрому распространению в окружающие ткани, метастазированию.
- Позитивный край резекции. Это говорит о том, что в пищеводе могли остаться раковые клетки.
- Сосудистая, периневральная, лимфатическая инвазия — когда опухолевая ткань прорастает в сосуды и нервы.
- Вторжение в подслизистую основу стенки пищевода.
Хирургическое лечение может быть дополнено химиотерапией и лучевой терапией, это помогает снизить риск рецидива.
Наши врачи вам помогут
Оставьте свой номер телефона
Лечение рака пищевода на стадиях IIB-III
При стадиях IIB и III злокачественная опухоль сильнее прорастает в стенку пищевода и может распространяться в регионарные лимфатические узлы. В таких случаях одно только хирургическое лечение недостаточно эффективно, после него сохраняется высокий риск рецидива и отмечаются низкие показатели пятилетней выживаемости. Поэтому операции всегда дополняют адъювантной и неоадъювантной химиотерапией или химиолучевой терапией.
При неоперабельных опухолях (например, в шейном отделе пищевода) и противопоказаниях к операции основным методом лечения становится химиолучевая терапия.
В клинике Медицина 24/7 работают ведущие хирурги. В операционных, оснащенных современным оборудованием от ведущих производителей, выполняются хирургические вмешательства на пищеводе любой сложности.
Паллиативные операции при раке пищевода
Наиболее распространенное осложнение при раке пищевода — нарушение проходимости органа из-за сужения опухолью, которое затрудняет питание и приводит к сильному истощению больного. В таких случаях может быть выполнено стентирование. В заблокированный участок пищевода устанавливают стент — короткую трубку с сетчатой стенкой из металла или пластика. После этого проходимость сразу восстанавливается, и пациент снова может нормально питаться.
Другие методы лечения опухолевого стеноза пищевода:
- Эндоскопические процедуры: деструкция (разрушение) опухоли электрокоагулятором или лазером, фотодинамическая терапия, баллонная дилятация — когда в заблокированный участок вводят специальный спущенный баллон и раздувают внутри, тем самым расширяя просвет органа. Эти методы дают лишь временный эффект, обычно их применяют перед операцией.
- Лучевая терапия: внешнее облучение, или брахитерапия — когда источник излучения помещают прямо в пищевод. Помимо нарушения глотания, лучевую терапию применяют для борьбы с такими симптомами рака пищевода, как боль и кровотечение.
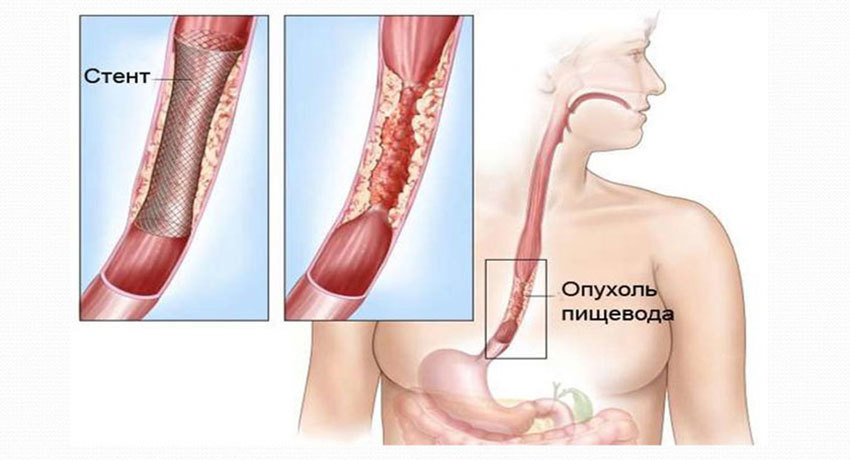
В некоторых случаях злокачественная опухоль приводит к формированию свищей — отверстий, которые соединяют пищевод с бронхами, средостением. Для борьбы с этим осложнением применяют специальные покрытые стенты, которые прижимаются к отверстию и закрывают его. Эта процедура эффективна в 70–100% случаях.
Мы вам перезвоним
Оставьте свой номер телефона
Наблюдение после хирургического лечения
Пациенты, перенесшие радикальную операцию по поводу рака пищевода, должны регулярно являться на контрольные осмотры к врачу:
- В первые два года — каждые 3–6 месяцев.
- В последующие 3–5 лет — каждые 6–12 месяцев.
- Далее — раз в год.
Если у пациента появляются симптомы, которые могут свидетельствовать о прогрессировании заболевания, назначают инструментальные исследования и анализы крови.
После эндоскопических операций на ранних стадиях рака пищевода пациенты должны проходить эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки (ЭГДС) в первый год каждые 3 месяца, в последующие 2–3 года — каждые 6 месяцев, далее — раз в год.
В клинике Медицина 24/7 вопросам реабилитации онкологических больных после завершения лечения уделяется большое внимание. У нас проводят консультации и осмотры ведущие врачи, каждый пациент получает подробные рекомендации по поводу образа жизни и контрольных обследований. Мы применяем наиболее современные технологии и противоопухолевые препараты, оказываем помощь на уровне ведущих онкологических центров мира, что позволяет достигать наилучших результатов лечения и показателей выживаемости.
Материал подготовлен врачом-онкологом, торако-абдоминальным хирургом, заведующим операционным блоком клиники «Медицина 24/7» Коротаевым Александром Валерьевичем.
Источник
Хирургия пищевода ¦ Операции при раке пищевода
Абдоминальный этап
Положение больного – на спине с валиком на уровне мечевидного отростка грудины. Доступ-верхне-срединная лапаротомия. Ревизия и мобилизация для ревизии.
Для лучшей ориентации и оценки состояния лимфатических узлов в области развилки чревного ствола вскрывается сальниковая сумка в бессосудистом участке ближе к печени.
Подозрительные по метастазированию лимфатические узлы верифицируют с помощью пункционной биопсии, в ряде случаев их удаляют для морфологического исследования, а также для исследования чувствительности опухоли к химиопрепаратам. Пальпаторно и визуально оценивают состояние поверхности печени. Подозрительные участки пунктируют.
При отсутствии неудалимых метастазов в органы и регионарные лимфатические узлы ниже диафрагмы и локализации опухоли в среднегрудном отделе пищевода или в его нижней трети с переходом на желудок при резектабельном процессе возможно выполнение одномоментной резекции и пластики пищевода в самостоятельном хирургическом плане, либо, что предпочтительнее, в сочетании с послеоперационной лучевой терапией.
Техника гастростомии из передней стенки желудка достаточно проста: на переднюю стенку желудка у малой кривизны, отступя от привратника 8-10 см., накладывают лигатурную держалку. Вторую держалку накладывают в 6 см в дистальном направлении. С помощью держалок, поднимая переднюю стенку желудка, формируют складку и на нее в антиперистальтическом направлении накладывают бранши аппарата НЖКА-60 таким образом, чтобы сформировалась коническая трубка основанием к желудку.
Линию механического шва перитонизируют отдельными узловыми серозно-мышечными швами. Верхушка сформированной трубки через дололнительный разрез в левом подреберье выводится наружу и фиксируется двумя швами к апоневрозу.
Проверяется брюшная полость на отсутствие кровотечения и после этого лапаротомная рана ушивается наглухо.
Через отверстие гастростомы в желудок вводят тонкий резиновый зонд для питания и декомпрессии. В последующем, введением желудочных зондов с постепенно возрастающим диаметром ширины отверстия гастростомы доводится до оптимальной величины.
Субтотальная резекция пищевода
Целью этой операции является удаление единым блоком грудного отдела пищевода с опухолью, окружающей пищевод клетчаткой, паратрахеальными, верхними и нижними трахеобронхиальными (бифуркационными), задними средостенными (околопищеводными) лимфатическими узлами.
Доступ: правосторонняя передне-боковая торакотомия по пятому межреберью при поражении верхней и средней трети пищевода и по шестому-при поражении его нижней трети. Пальпаторно и визуально оценивают состояние париетальной, висцеральной плевры и легочной ткани с целью обнаружения возможных метастазов.
При отсутствии признаков опухолевой диссеминации по плевре легкое отводят кпереди.
Далее приступают к мобилизации пищевода и ревизии средостения.
Мобилизация для ревизии и ревизия
Пересекают нижнюю легочную связку и тупо мобилизуют легкое до нижней легочной вены, смещая лимфатические узлы к пищеводу.
Над пищеводом спереди него и сзади на всем протяжении от диафрагмы до купола плевры рассекают медиастинальную плевру, оставляя на пищеводе полоску шириной около 3 см.
Далее пальпаторно определяют верхний и нижний край опухоли, оценивают ее связь с позвоночником, аортой, трахеей, главными бронхами.
Выше и ниже опухоли на расстоянии 3-4 см пальцем обходят вокруг пищевода, через образовавшиеся каналы проводят резиновые держалки. При потягивании за них еще раз оценивают возможность удаления пищевода.
Мобилизация для резекции
Тупым и острым путем с помощью зажимов и лигирования сосудистых образований выделяют пищевод с окружающей клетчаткой, околопищеводными лимфатическими узлами (от диафрагмы до верхне грудной апертуры), единым блоком с бифуркационными лимфатическими узлами. При этом по возможности нужно сохранять веточки блуждающих нервов, отходящие к легким.
При мобилизации в средней трети пищевода пересекают и лигируют пищеводные артерии отходящие, как правило, от передней поверхности аорты.
Ниже отхождения легочных ветвей блуждающие нервы пересекают. При прорастании опухолью непарной вены ее выделяют, прошивают аппаратом УС и дополнительно перевязывают. При отсутствии прорастания непарную вену сохраняют. После мобилизации пищевода и околопищеводной клетчатки на всем протяжении внутригрудного отдела пищевода надсекают пищеводно-диафрагмальную связку и мобилизуют пищевод в области пищеводного отверстия диафрагмы.
Потягивая за пищевод в плевральную полость выводят кардиальный отдел желудка. На уровне кардиального жома пересекают блуждающие нервы, прошивают пищевод двумя аппаратами УО и пересекают между механическими швами. Проксимальный конец пищевода помещают в резиновый колпачок или укрывают салфеткой. Дистальную линию механического шва погружают узловыми швами, затем ушивают пищеводное отверстие диафрагмы.
Проксимальная граница резекции пищевода должна отстоять от верхнего края опухоли не менее 5 см. На этом уровне пищевод прошивают аппаратом УО и ниже накладывают зажим. Пересекают пищевод между аппаратом и зажимом. Препарат удаляют. Если опухоль локализуется в верхней трети пищевода, пищевод прошивают аппаратом УО и пересекают под куполом плевры. Производят срочное морфологическое исследования по проксимальному и дистальному краям резекции для исключения возможного пересечения пищевода по опухоли.
Плевральная полость промывается растворами антисептков и после проверки на гемостаз и герметичность легкого (если производились манипуляции на нем) ушивают наглухо с оставлением двух плевральных дренажей (верхнего – на уровне 2 межреберья и нижнего -на уровне 7 межреберья).
Шейный этап операции
В положении больного на спине с валиком на уровне лопаток и небольшим поворотом головы вправо послойно рассекают кожу и мягкие ткани по медиальному краю левой кивательной мышцы (грудино-ключично-сосцевидной) до претрахеальной фасциальной пластинки, рассекают ее продольно. Сосудистый пучок тупым крючком смещают кнаружи.
В рану выводят оставшуюся часть шейного отдела пищевода и подшивают в глубине раны к окружающим мышцам, герметизируя средостение. Рану ушивают до пищевода. Мышечная стенка пищевода над механическим швом рассекается до подслизистого слоя. Часть пищевода с механическим швом удаляют. Слизистую подшивают к коже шеи.
При получении данных срочного морфологического исследования о наличии опухолевых элементов в крае резекции дополнительно резецируют 1-2 см. пищевода и только затем формируют эзофагостому.
В тех случаях, когда опухолевое поражение локализуется высоко, вплоть до глотки, производят экстирпацию оставшейся части пищевода. Для этого разрез продлевают выше, широко обнажают левую долю щитовидной железы, пересекают с лигированием нижнюю щитовидную артерию, проследив ход и сохранив левый возвратный нерв и паращитовидные тельца.
Вытягивая культю пищевода мобилизуют ее до гортаноглотки. Край кивательной мышцы подшивают к предпозвоночной фасции в глубине раны. Этим достигается укрытие сосудистого пучка и герметизация верхнего средостения. Края кожи отсепаровываются в стороны. Вскрывается гортаноглотка, край кожи подшивается по краю остающейся части гортаноглотки в глубине раны, формируя боковую фарингостому.
Формирование шейного пищеводно-желудочного анастомоза
Мобилизуют конец собственного пищевода окаймляющим разрезом вокруг эзофагостомы на протяжении ок 3 см. Рассекают циркулярно вокруг стомы мышечную оболочку, затем отсекают слизистую. Рассекают по задне-правой стенке на уровне эзофагостомы стенку желудочной трубки на протяжении диаметра эзофагостомы до подслизистого слоя.
Затем отдельными узловыми швами сшивают мышечные оболочки культи пищевода и желудочной трубки по задней губе формируемого анастомоза. Вскрывают просвет желудочной трубки и формируют второй ряд швов анастомоза внутрипросветными узловыми швами по передней и задней полуокружностям анастомоза. Затем формируют второй ряд серозно-мышечных швов на передней стенке анастомоза.
Оптимальным является формирование анастомоза по типу “конец – в бок”. Кожа над анастомозом зашивается до устья верхушки желудочной трубки, где формируется отверстие гастростомы подшиванием слизистой к коже. В отверстие гастростомы вводят тонкий резиновый зонд для питания и декомпрессии. При отсутствии уверенности в качестве кровоснабжения искусственного пищевода анастомоз формируют спустя 1-3 мес. Техника формирования анастомоза может варьировать в зависимости от склонности хирурга к тому или иному техническому варианту.
(495) 506-61-01 – где лучше оперировать пищевод
ЗАПРОС в КЛИНИКУ
Источник

