Слизисто бикарбонатный барьер желудка
В статье приведено значение слизисто-бикарбонатного барьера желудка при кислотозависимых заболеваниях
 Актуальность кислотозависимых заболеваний, таких как язвенная болезнь, гастропатии, индуцированные приемом нестероидных противовоспалительных препаратов (НПВП), определена их распространенностью в популяции, а также влиянием на качество и прогноз жизни пациентов [1].
Актуальность кислотозависимых заболеваний, таких как язвенная болезнь, гастропатии, индуцированные приемом нестероидных противовоспалительных препаратов (НПВП), определена их распространенностью в популяции, а также влиянием на качество и прогноз жизни пациентов [1].
Современные представления о патогенезе всех кислотозависимых заболеваний сводятся к нарушению равновесия между факторами агрессии и факторами защиты, основные элементы которых впервые отображены в концепции патогенеза язвенной болезни, предложенной H. Shay и D.C.H. Sun [2].
Факторы агрессии при язвенной болезни, с точки зрения современных научных исследований, включают в себя изменение массы обкладочных клеток, нарушение нервной и гуморальной регуляции секреции соляной кислоты (в частности, гастрином), гиперпродукцию пепсиногена и контаминацию слизистой оболочки желудка Helicobacter pylori. Причем инфекционному агенту отдается приоритетное значение [3].
Ослабление факторов защиты при язвенной болезни возникает в результате нарушения физико-химических свойств желудочной слизи и регенераторной активности эпителиальных клеток, а также изменения кровоснабжения слизистой оболочки гастродуоденальной зоны, синтеза простагландинов и оксида азота [3].
Патогенез НПВП-гастропатии также полностью соответствует концепции нарушения равновесия факторов агрессии и факторов защиты. К факторам агрессии очевидно относятся сами НПВП, которые за счет стимуляции секреции соляной кислоты и пепсиногена, усиления апоптоза эпителиальных клеток, повышения образования свободных радикалов, фактора некроза опухоли обладают ульцерогенным действием. Вместе с тем угнетение НПВП активности фермента циклооксигеназы вызывает нарушение синтеза простагландинов, снижение кровотока в слизистой оболочке желудка, уменьшение выработки слизи и бикарбонатов [4].
В последние годы обсуждение в научной литературе значения факторов защиты при кислотозависимых заболеваниях, к сожалению, уменьшается. Связано это с тем, что медицина, основанная на доказательствах, в настоящее время в вопросах профилактики и лечения язвенной болезни и НПВП-гастропатии подтверждает высокое значение только эрадикации H. pylori и применения ингибиторов протонной помпы (ИПП) [1]. Следует ли из этого, что дискуссия о значении факторов защиты при кислотозависимых заболеваниях не заслуживает внимания в клинической практике, – вопрос, на который настоящая статья делает попытку ответить.
Основные элементы факторов защиты при кислотозависимых заболеваниях традиционно делят на несколько уровней. Первый уровень – слизисто-бикарбонатный барьер, или предэпителиальный уровень. Второй уровень – покровный эпителий, формирующий барьер на пути химических, физических и, самое главное, пептических и биологических факторов. Третий уровень – комплекс клеток и матрикса собственной пластинки, обеспечивающий питание и контроль кинетики покровного эпителия, реализацию реакций иммунной защиты [5].
Слизисто-бикарбонатный барьер желудка (СББЖ) – это физико-химический барьер, который представляет собой нерастворимый высокоэластичный гель на поверхности покровного эпителия, поддерживающий рН нейтральной среды. Эффективность барьерной функции слизистого геля определяется тремя ключевыми параметрами: 1) структурой геля, от которой зависит стабильность и проницаемость слоя слизи; 2) толщиной слизистой пленки; 3) рН геля.
В структуре геля СББЖ выделяют верхнюю (лабильную) фазу геля и нижнюю (постоянную) фазу геля, которая не удаляется в процессе моторики и уравновешена к действию пептических факторов в норме. Отдельно выделяют в структуре геля фосфолипидный слой [6, 7]. Верхняя фаза слизи состоит в основном из секрета слюнных желез и, в меньшей степени, секрета кардиальных желез. Нижняя фаза слизи представляет собой секрет покровноямочного эпителия.
В состав геля входят: соли и другие диализуемые компоненты – 1 %, свободные белки, нуклеиновые кислоты и липиды – 0,5-2%, муцины – 3%. Гидратация геля составляет 95% [8]. Несмотря на относительно малую долю в составе геля, ключевыми химическими элементами, определяющими его физико-химические свойства, являются муцины. Современные гистохимические методики позволили выделить несколько типов муцинов в слизистой оболочке желудка: MUC1 (мембраносвязанный муцин), MUC5AC и MUC6 (секретируемые муцины). MUC5AC экспрессируется преимущественно в поверхностном эпителии, а MUC6 – в желудочных железах [9].
Муцины – гликопротеины, имеющие специфический аминокислотный состав с высоким содержанием серина, треонина и пролина и большим содержанием углеводов с характерным набором моносахаридных остатков. Концентрация муцинов в слизи желудка человека в зависимости от методики определения составляет около 50 мг/мл. В структуре молекулы муцина белок располагается в центре, а ближе к периферии находится высокогликозилированная зона, составляющая до 80% общей массы молекулы муцина. Центральные домены обеспечивают формирование крупных муциновых мультимеров за счет дисульфидных мостиков, а образование олигосахаридных цепей регулируется системой гликозилтрансфераз [8]. Вместе с тем точный молекулярный механизм сшивки молекул в геле до конца не изучен. В частности, установлено, что гелеобразование при низких значениях рН включает сложные электростатические и гидрофобные взаимодействия с образованием нековалентных сшивок конкретных регионов доменов муцинов [6].
Помимо традиционно изучаемой гелеобразующей функции муцинов современные исследования показывают их огромную роль в резистентности к инфекционным агентам. Известно, что MUC5АС, препятствуя адгезии H. pylori, защищает поверхностный эпителий желудка, а MUC6 характеризуется антибактериальной активностью [10].
Важным компонентом, определяющим свойства муцинов в желудке, является семейство белков слизи – трефоиловые пептиды. Трефоиловые пептиды секретируются мукоцитами и выполняют разнообразные функции. Данный спектр протеинов контролирует процесс синтеза и секреции муцинов, степень их гликозилирования и диффузию протонов водорода [11].
Изучение второго ключевого параметра барьерной функции слизистого геля определило, что в условиях покоя толщина слизистой пленки имеет постоянное значение около 180 мкм [8]. Удаление поверхностной жидкой фазы слизи ведет к увеличению ее продукции. Изменение толщины слизи в различных отделах желудка связано в основном с лабильной фазой геля, тогда как стабильная фаза геля остается неизменной.
Образование слизи представляет собой сложный процесс, полный цикл которого занимает до 2 часов. Регуляция продукции слизи обеспечивается нейрогуморальными и паракринными факторами, ведущее значение среди которых имеют ацетилхолин, простагландины и оксид азота (NO). Так, снижение образования оксида азота приводит к падению скорости продукции слизи, как и блокада метаболизма простагландинов уменьшает скорость накопления слизи [12].
Важнейшей химической характеристикой СББЖ является рН, равный 6,7-7,0, за счет присутствия HCO3- в составе слизистого геля. Кроме того, рН геля определяет его реологию: чем ниже рН, тем ниже вязкость. Идентифицирован апикальный транспортер HCO3- в эпителиальных клетках желудка – SLC26A9. Исследования показали, что SLC29A9 является посредником при Cl/HCO3–обмене, однако функционирование SLC29A9 возможно и по Cl-независимой HCO3-секреции. В отличие от других транспортных белков, известных на сегодняшний день, активность SLC29A9 тормозится аммонием, что крайне важно для понимания влияния H. pylori на СББЖ [13].
Структура геля, толщина слизистой пленки и рН геля в итоге определяют его уникальную устойчивость к физико-химическим воздействиям. Так, экспозиция желудочного слизистого геля в растворах с рН от 1 до 8, с различными осмотическими характеристиками или с желчью не сопровождается дисперсией геля и изменением его реологических свойств. Растворение слизистого геля возможно в результате протеолиза, ведущего к нарушению мультимерной структуры муцинов. В норме поддерживается баланс между уровнем продукции всех компонентов слизи и ее расщеплением протеазами.
В настоящее время накоплено достаточно научных данных о негативном влиянии H. pylori, НПВП и желчных кислот на СББЖ [14]. Основной мишенью для желчных кислот среди прочих мишеней в СББЖ является слой фосфолипидов, концентрация которых резко снижается при воздействии на них жирных кислот. НПВП за счет блокады простагландинового механизма регуляции работы СББЖ приводят к снижению продукции слизи, бикарбонатов, уменьшению толщины слизистого слоя геля. Интегральным результатом взаимодействия H. pylori со СББЖ является изменение доли мультимерных муцинов и рН слизистого геля, что в конечном итоге приводит к потере стабильности его физико-химических свойств.
В частности, результаты метаанализа 11 исследований, проведенного Yaron Niv, продемонстрировали взаимосвязь между H. pylori и экспрессией секретируемых муцинов MUC5АС и MUC6. Выявлено, что экспрессия муцина MUC6 была выше у Н. pylori-позитивных пациентов в сравнении с Н. pylori-негативными (ОШ 9,2; 95% ДИ: 1,5-54,5; р=0,014). В то же время экспрессия MUC5AC у Н. pylori-позитивных пациентов была достоверно ниже (ОШ 0,44; 95% ДИ: 0,21-0,95; р=0,036). Сделано заключение об ингибирующей роли H. pylori в отношении экспрессии MUC5AC в эпителии желудка, что облегчает его колонизацию. В то же время увеличение экспрессии MUC6 может способствовать подавлению колонизации H. pylori за счет антибактериальных свойств данного муцина. Таким образом, влияние на экспрессию данных муцинов может повышать эффективность эрадикационной терапии [10].
Наряду с коррекцией факторов агрессии длительное время в реальной клинической практике концепция усиления факторов защиты при кислотозависимых заболеваниях реализовывалась препаратами с гастропротективным эффектом. К данной группе препаратов из зарегистрированных в настоящее время в России можно отнести сукральфат, висмута трикалия дицитрат, мизопростол и ребамипид. Из всех этих препаратов на основании концепции доказательной медицины только мизопростол был включен в ряд национальных и международных рекомендаций в отношении НПВП-гастропатии [1]. Однако прямые сравнительные исследования мизопростола и ИПП показали достоверное преимущество последних в эффективности и безопасности [15].
Новая ступень в понимании и совершенствовании терапевтических технологий контроля кислотозависимых заболеваний, очевидно, связана с открытием влияния ИПП на физико-химические характеристики СББЖ, которые именуются экспертами как плейотропные. Вместе с тем данный эффект обнаружен только у ИПП последнего поколения – оригинального рабепразола (Париета) [16].
В двойном слепом плацебо-контролируемом исследовании T. Skoczylas et al. продемонстрировано увеличение базальной секреции слизи желудка на 31% (с 2,28±0,36 до 3,31±0,38 мг/мл; р<0,01) и стимулированной пентагастрином на 65% (с 1,5±0,32 до 3,36±0,39 мг/мл; р<0,0001) после 7-дневного приема здоровыми добровольцами оригинального рабепразола в дозе 20 мг/сут Париет® также влиял на концентрацию желудочного муцина, которая увеличилась на базальном уровне на 41% (с 0,58±0,09 до 0,82±0,09 мг/мл; р<0,01) и в 2,6 раза (с 0,36±0,06 до 0,96±0,08 мг/мл) после стимуляции пентагастрином (р<0,0001) [17].
T. Jaworski et al. в двойном слепом плацебо-контролируемом перекрестном исследовании на здоровых добровольцах показали, что НПВП (в исследовании использовался напроксен 500 мг/сут) совместно с плацебо в течение 7 дней снижает базальную секрецию муцина железами желудка на 39% (с 86,9 (53,5÷135) мг/ч до 53,1 (27,1÷81,9) мг/ч; р<0,01), а стимулированную пентагастрином – на 49% (с 88,1 (49,3÷131) до 45,0 (31,0÷61,7) мг/ч; р<0,003). Концентрация желудочного муцина на фоне напроксена/плацебо снижалась с 0,54 (0,40÷0,77) мг/мл до 0,42 (0,22÷0,47) мг/мл; р<0,05. Вместе с тем курс напроксена 500 мг/сут совместно с оригинальным рабепразолом (Париетом) 20 мг/сут увеличивал секрецию муцина: базальную – на 40% (75,8±8,97 мг/ч; р=0,05), а стимулированную пентагастрином – на 67% (75,3 (55,0÷113) мг/ч; р=0,003) по сравнению с таковой при использовании напроксена с плацебо. Концентрация желудочного муцина на фоне терапии рабепразолом также была достоверно выше (на 62%) по сравнению с группой плацебо и составила 1,09 (0,81÷1,44) мг/мл, р<0,001 [18].
Уникальность плейотропных эффектов Париета можно характеризовать как универсальную за счет влияния на слизисто-бикарбонатный барьер не только желудка, но и пищевода [19]. Irene Sarosiek et al. изучили секрецию муцина у больных гастроэзофагеальной рефлюксной болезнью до и после 8-недельной терапии оригинальным рабепразолом в дозе 20 мг/сут. Исследование проводили в 4 этапа, которые имитировали гастроэзофагеальный рефлюкс: на I этапе изучали базовую секрецию и вводили раствор NaCl, на II и III этапах последовательно осуществляли инфузию HCl/пепсина, на IV этапе вновь вводили NaCl. Клиническая и эндоскопическая оценка курса терапии выявила у 93% пациентов полную ремиссию. Отмечен важный результат исследования: повышение концентрации муцина в эзофагеальном секрете на фоне приема оригинального рабепразола наблюдалось на всех этапах исследования от 118% (р=0,013) на I этапе до 455% на IV этапе (р<0,001) [20].
Поиск непосредственного механизма влияния рабепразола на СББЖ и пищевода составляет актуальную задачу современных исследований. В настоящее время предполагается, что плейотропный эффект оригинального рабепразола (Париета) связан с его уникальным воздействием на NO-синтазу – продуцент оксида азота, а как известно, NO – один из основных регуляторов слизисто-бикарбонатного барьера [21].
В заключение анализа представленной информации важно отметить, что концепция патогенеза рассматриваемых в настоящей статье кислотозависимых заболеваний как нарушения равновесия факторов агрессии и факторов защиты актуальна и удовлетворяет основные запросы в терапии указанной патологии. Возможность терапевтического влияния на факторы защиты обоснована не только теоретическими, но и экспериментальными данными. Вместе с тем в настоящее время как при язвенной болезни, так и при НПВП-гастропатии акцент в профилактике и лечении, безусловно, сосредоточен на коррекции факторов агрессии: эрадикации Н. pylori и назначении ИПП.
Особенно важно отметить, что указанные положения (эрадикация Н. pylori и/или применение ИПП) являются не просто рекомендательными для практических врачей, а обязательными для исполнения, с учетом современной законодательной базы. Так, в «Стандарте медицинской помощи больным язвой желудка и двенадцатиперстной кишки», утвержденном приказом Министерства здравоохранения и социального развития Российской Федерации от 22 ноября 2004 г. № 241, и в «Стандарте медицинской помощи больным хроническим гастритом, дуоденитом, диспепсией», утвержденном приказом Министерства здравоохранения и социального развития Российской Федерации от 22 ноября 2004 г. № 248, речь идет об обязательном проведении эрадикации Н. pylori при ее выявлении и назначении антисекреторных препаратов из группы ИПП: омепразола или рабепразола (Париета).
Препараты с гастропротективным эффектом не вошли в указанные федеральные стандарты, что обосновано их недостаточной доказательной базой. В то же время практический врач, считающий целесообразным назначение терапии, направленной на усиление факторов защиты, по результатам представленного анализа, может среди других аспектов выбора руководствоваться и выявленными у оригинального рабепразола (Париета) плейотропными эффектами.
Источник
Внешнесекреторная функция желудка направлена на защиту стенки желудка от повреждений (в том числе самопереваривания) и на переваривание пищи. Поверхностныйэпителийслизистой оболочки желудка вырабатывает муцины (слизь) и бикарбонат и выполняет защитную функцию путём формирования слизисто-бикарбонатного барьера, находящегося на поверхности эпителия. Слизистая оболочка в различных отделах желудка содержиткардиальные,фундальныеипилорическиежелезы (рис. 22-4Б). Кардиальные железы вырабатывают преимущественно слизь, фундальные (80% всех желёз желудка) – пепсиноген, соляную кислоту, внутренний факторКасла и некоторое количество слизи; пилорические железы секретируют слизь игастрин.
Слизисто-бикарбонатный барьер
Слизисто-бикарбонатный барьер защищает слизистую оболочку от действия кислоты, пепсина и других потенциальных повреждающих агентов.
Слизьпостоянно секретируется на внутреннюю поверхность стенки желудка.
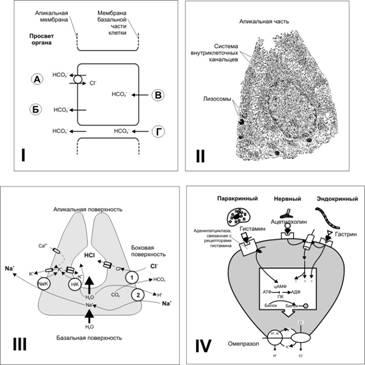
Бикарбонат(ионы HCO3-), секретируемый поверхностными слизистыми клетками (рис. 22-7,I), имеет нейтрализующее действие.
pH. Слой слизи имеет градиент pH. На поверхности слоя слизи pH равен 2, а в примембранной части более 7.
Н+. Проницаемость плазмолеммы слизистых клеток желудка для Н+различна. Она незначительна в мембране, обращённой в просвет органа (апикальной), и достаточно высока в базальной части. При механическом повреждении слизистой оболочки, при воздействии на неё продуктов окисления, алкоголя, слабых кислот или жёлчи концентрация H+в клетках возрастает, что приводит к их гибели и разрушению барьера.

Рис.22-7.ЖЕЛУДОЧНАЯСЕКРЕЦИЯ.I-.МеханизмсекрецииHCO3-эпителиальнымиклеткамислизистойоболочкижелудкаидвенадцатиперстнойкишки:А- выход HCO3-в обмен на Cl-стимулируют некоторые гормоны (например, глюкагон), и подавляет блокатор транспорта Cl- фуросемид.Б- активный транспорт HCO3-, не зависящий от транспорта Cl-;ВиГ- транспорт HCO3-через мембрану базальной части клетки внутрь клетки и по межклеточным пространствам (зависит от гидростатического давления в подэпителиальной соединительной ткани слизистой оболочки).II-Париетальнаяклетка. Система внутриклеточных канальцев значительно увеличивает площадь поверхности плазматической мембраны. В многочисленных митохондриях вырабатывается АТФ для обеспечения работы ионных насосов плазматической мембраны..III-Париетальнаяклетка:транспортионовисекрецияHCl. Na+,К+‑АТФаза участвует в транспорте K+ внутрь клетки. Cl-входит в клетку в обмен на HCO3-через мембрану боковой поверхности (1), а выходит через апикальную мембрану; 2 – обмен Na+на H+. Одно из важнейших звеньев – выход H+через апикальную мембрану по всей поверхности внутриклеточных канальцев в обмен на K+при помощи H+,К+‑АТФазы..IV-Регуляцииактивностипариетальныхклеток. Стимулирующее влияние гистамина опосредуется через цАМФ, тогда как эффекты ацетилхолина и гастрина – через увеличение притока Са2+в клетку. Простагландины снижают секрецию HCl, ингибируя аденилатциклазу, что приводит к уменьшению уровня внутриклеточного цАМФ. Блокатор H+,K+‑АТФазы (например, омепразол) снижает выработку HCl. ПК – протеинкиназа, активируемая цАМФ; фосфорилирует мембранные белки, усиливая работу ионных насосов. [11].
Регуляция. Секрецию бикарбоната и слизиусиливаютглюкагон, простагландин Е,гастрин, эпидермальный фактор роста. Для предупреждения повреждения и для восстановления повреждённого барьера применяют антисекреторные агенты (например, блокаторы гистаминовых рецепторов), простагландины, гастрин, аналоги сахаров (например, сукральфат).
Разрушениебарьера. При неблагоприятных условиях барьер разрушается в течение нескольких минут, происходят гибель клеток эпителия, отёк и кровоизлияния в собственном слое слизистой оболочки. Известны факторы, неблагоприятные для поддержания барьера:нестероидные противовоспалительные препараты (например, аспирин, индометацин);этанол,соли жёлчных кислот,Helicobacterpylori- грамотрицательная бактерия, выживающая в кислой среде желудка.H.pyloriпоражает поверхностный эпителий желудка и разрушает барьер, способствуя развитию гастрита и язвенного дефекта стенки желудка. Этот микроорганизм выделяют у 70% больных язвенной болезнью желудка и 90% больных язвой двенадцатиперстной кишки или антральным гастритом.
Регенерацияэпителия, формирующего слой бикарбонатной слизи, происходит за счёт стволовых клеток, расположенных на дне желудочных ямок; время обновления клеток – около 3 суток. Стимуляторы регенерации:гастрин из эндокринных клеток желудка,гастрин-рилизинг гормон из эндокринных клеток и окончаний волокон блуждающего нерва,эпидермальный фактор роста, поступающий из слюнных, пилорических желёз, желёз двенадцатиперстной кишки и других источников.
Слизь. Помимо поверхностных клеток слизистой оболочки желудка, слизь секретируют клетки практически всех желёз желудка.
Пепсиноген. Главные клетки фундальных желёз синтезирует и секретирует предшественники пепсина (пепсиноген), а также небольшое количество липазы и амилазы. Пепсиноген не обладает пищеварительной активностью. Под влиянием соляной кислоты и особенно ранее образованного пепсина пепсиноген превращается в активный пепсин. Пепсин – протеолитический фермент, активный в кислой среде (оптимум pH от 1,8 до 3,5). При pH около 5 он практически не имеет протеолитической активности и за короткое время полностью инактивируется.
Внутренний фактор. Для всасывания витамина B12в кишечнике необходим (внутренний) факторКасла, синтезируемый париетальными клетками желудка. Фактор связывает витамин B12и защищает его от разрушения ферментами. Комплекс внутреннего фактора с витамином B12в присутствии ионов Ca2+взаимодействует с рецепторами эпителиальной клетки дистального отдела подвздошной кишки. При этом витамин B12поступает в клетку, а внутренний фактор высвобождается. Отсутствие внутреннего фактора приводит к развитию анемии.
Соляная кислота
Соляную кислоту (HCl) вырабатывают париетальные клетки, имеющие мощную систему внутриклеточных канальцев (рис. 22-7,II), существенно увеличивающих секреторную поверхность. Клеточная мембрана, обращённая в просвет канальцев, содержит протонныйнасос(H+,K+-ATФaза), выкачивающий из клетки Н+в обмен на К+.Хлорно-бикарбонатныйанионообменниквстроен в мембрану боковой и базальной поверхности клеток: Cl-входит в клетку в обмен на HCO3-через этот анионообменник и выходит в просвет канальцев. Таким образом, в просвете канальцев оказываются оба компонента соляной кислоты: и Cl-, и H+. Все остальные молекулярные компоненты (ферменты, ионные насосы, трансмембранные переносчики) направлены на сохранение ионного баланса внутри клетки, прежде всего – на поддержание внутриклеточного pH.
Таким образом, механизм образования соляной кислоты (рис. 22-7,II) складывается из следующих этапов.
Ионы хлора активно транспортируются из цитоплазмы обкладочных клеток в просвет внутриклеточных канальцев, а ионы натрия переносятся наружу. Эти два эффекта создают в канальцах потенциал (от -40 до -70 мВ), приводящий к диффузии большого количества ионов калия и некоторого количества ионов натрия внутрь канальцев.
В цитоплазме клетки вода диссоциирует на водородные и гидроксильные ионы. Водородные ионы посредством активного транспорта секретируются внутрь канальцев в обмен на ионы калия. Этот процесс катализирует H+, K+‑АТФаза. В результате ионы калия и натрия, которые диффундировали внутрь канальцев, реабсорбируются в цитоплазму клеток, а ионы водорода занимают их место в канальцах, создавая там раствор концентрированной соляной кислоты, который через секреторные канальцы поступает наружу, т.е. на поверхность эпителия желудка.
Вода проходит внутрь канальцев под воздействием осмоса. В результате секрет канальцев содержит соляную кислоту в концентрации 150-160 ммоль/л, хлорид калия в концентрации 15 ммоль/л и небольшое количество хлорида натрия.
На заключительным этапе углекислота, образующаяся в ходе метаболизма клетки, под влиянием карбоангидразы соединяется с гидроксильными ионами, образуя бикарбонатные ионы. Бикарбонатные ионы диффундируют из цитоплазмы во внеклеточную жидкость в обмен на ионы хлора, входящие в клетку и в дальнейшем секретируемые в канальцы париетальных клеток.
Впокоеклетка секретирует хлор.
Пристимуляцииусиливается работа Н+,К+‑АТФазы, в результате чего возрастает транспорт Н+из клетки. Одновременно в 2-3 раза увеличивается транспорт Cl-в обмен на HCO3-. В итоге внутриклеточный pH остаётся неизменным. Стимуляция обкладочных клеток вызывает выделение кислого раствора, изотоничного внеклеточной жидкости, содержащего 160 ммоль/л соляной кислоты с величиной pH раствора около 0,8. Содержание водородных ионов в этом растворе в 3 млн раз выше, чем в артериальной крови.
Регуляциясекрециисолянойкислотыпредставлена на рис. 22-7,IV. Париетальная клетка активируется через м‑холинорецепторы (блокатор – атропин), Н2-рецепторы гистамина (блокатор – циметидин) и рецепторы гастрина (блокатор – проглюмид). Указанные блокаторы или их аналоги, а также ваготомия используются для подавления секреции соляной кислоты. Существует ещё один способ понизить выработку соляной кислоты – блокада Н+,К+‑АТФазы.
Источник
