Роль соляной кислоты для переваривания белков в желудке
Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры.
Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
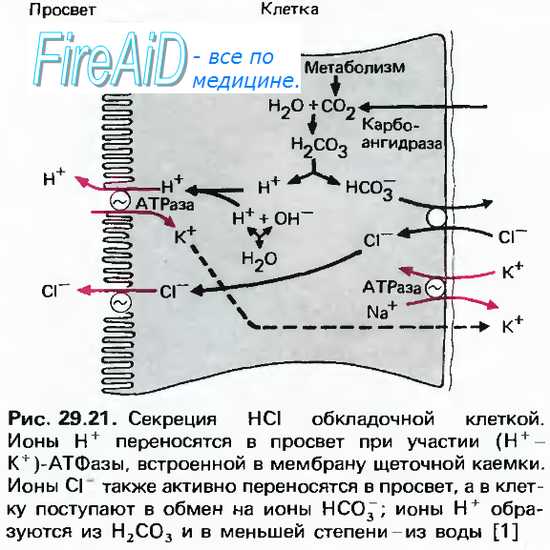
Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+(Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии.При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидныйгастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения.
Функции соляной кислоты: денатурация белков пищи; бактерицидное действие; высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания; превращение неактивного пепсиногена в активный пепсин; снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина; после перехода в 12-перстную кишку – стимуляция секреции панкреатического сока.
32. Переваривание белков в кишечнике. Покажите действие трипсина, карбокси-и аминопептидазы на конкретных примерах.
Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи.
Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы, соответственно, способомограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков.
В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.
Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы.
Синтезируемый в поджелудочной железе трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина.
Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групплизина и аргинина. Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу.Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз триацилглицеролов.
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатическихи ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
33. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры.
Аминокислоты и недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Такой процесс получил названиегниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой как токсины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород, метилмеркаптан (СН3SН) и другие), так инейромедиаторы (серотонин, гистамин, октопамин, тирамин). Всасываясь в кровь, эти вещества вызывают общую интоксикацию, колебания артериального давления, головные боли, понижение аппетита, понижение болевой чувствительности, анемии, миокардиодистрофии, нарушение желудочной секреции, в тяжелых случаях возможны угнетение дыхания, сердечной деятельности и кома.
34. Механизм обезвреживания продуктов гниения белков. Роль ФАФС и УДФ-ГК в этом процессе (конкретные примеры).
В процессе распада серосодержащих аминокислот (цистин,цистеин, метионин) в кишечнике образуются сероводород H2S и метил-меркаптан CH3SH. Диаминокислоты –орнитин и лизин – подвергаются процессу декарбоксилирования с образованием аминов – путресцина и кадаверина. Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальномдекарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсерная кислота или ска-токсилсерная кислота). Последние выделяются с мочой. Механизм обезвреживания этих продуктов изучен детально. В печени содержатся специфические ферменты – арилсульфотрансфераза и УДФ-глюкоронилтран-сфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы – 3′-фосфоаденозин-5′-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы – уридил-дифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов.
Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индолсвязывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой (см. главу 18). По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гип-пуровой кислоты с мочой после приема бензойной кислоты.
Таким образом, организм человека и животных обладает рядом защитных механизмов синтеза, биологическая роль которых заключается в обезвреживании токсичных веществ, поступающих в организм извне или образующихся в кишечнике из пищевых продуктов в результате жизнедеятельности микроорганизмов.
Переаминирование и декарбоксилирование аминокислот. Химизм процессов, характеристика ферментов и коферментов. Образование амидов.
Механизм реакции трансаминирования (переаминирования) непрост и протекает по типу “пинг-понг”. Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. На второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфатрегенерирует.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:пировиноградной с образованием аланина; щавелевоуксусной с образованием аспартата; α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени; окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках; дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках; катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани;жизнедеятельность бактерий толстого кишечника; распад пуриновых и пиримидиновых оснований – во всех тканях.
36. Дезаминирование аминокислот. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование аминокислот на примере тирозина.
Превращение аминокислот с участием NH2-группы сводится к ее отщеплению от углеродного скелета – реакции дезаминирования.
Типы дезаминирования
внутримолекулярное – с образованием ненасыщенной жирной кислоты:
восстановительное – с образованием насыщенной жирной кислоты:
гидролитическое – с образованием карбоновой гидроксикислоты:
окислительное – с образованием кетокислот:
У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Однако такие аминокислоты как серин и гистидин могут терять аминогруппу с использованием других типов дезаминирования, а треонин сразу подвергается прямому расщеплению до глицина и ацетальдегида.
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое инепрямое.
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесстрансдезаминирования (см ниже).
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве кетокислоты-акцептора в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат.
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой.
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Источник
Оглавление темы “Глотание. Пищеварение в желудке.”:
1. Глотание. Акт глотания. Фазы глотания. Пищевой комок.
2. Пищеварение в желудке. Функции желудка.
3. Секреторная функция желудка. Желудочный сок. Состав желудочного сока.
4. Соляная кислота. Механизм секреции соляной кислоты. Образование соляной кислоты в желудке.
5. Роль соляной кислоты в пищеварении. Функции соляной кислоты. Ферменты желудочного сока и их роль в пищеварении.
6. Желудочная слизь и ее значение. Слизь желудка. Функции желудочной слизи.
7. Регуляция секреции желудочного сока. Принципы секреции желудочного сока.
8. Фазы желудочной секреции. Нейрогуморальная фаза. Кишечная фаза.
9. Желудочная секреция при переваривании различных пищевых веществ. Секреция на белки. Секреция на углеводы. Секреция на молоко.
10. Сократительная деятельность мускулатуры желудка. Сокращение желудка. Работа желудка.
Роль соляной кислоты в пищеварении. Функции соляной кислоты. Ферменты желудочного сока и их роль в пищеварении.
Роль соляной кислоты в пищеварении.
В полости желудка хлористоводородная кислота:
1) стимулирует секреторную активность желез желудка;
2) способствует превращению пепсиногена в пепсин путем отщепления ингибирующего белкового комплекса;
3) создает оптимальную кислотность для действия протеолитических ферментов желудочного сока;
4) вызывает денатурацию и набухание белков (что способствует их расщеплению ферментами);
5) обеспечивает антибактериальный эффект секрета;
6) участвует в осуществлении механизма перехода пищи из желудка в двенадцатиперстную кишку, раздражая хеморецепторы ее слизистой оболочки;
7) участвует в регуляции секреции желудочных и поджелудочных желез, стимулируя образование гастроинтестинальных гормонов (гастрина, секретина);
8) возбуждает секрецию фермента энтерокиназы энтероцитами слизистой оболочки двенадцатиперстной кишки;
9) участвует в створаживании молока;
10) стимулирует моторную активность желудка.

Ферменты желудочного сока и их роль в пищеварении.
В полости желудка под влиянием протеолитических ферментов осуществляется начальный гидролиз белков до альбумоз и пептонов. Протеолитические ферменты желудочного сока обладают активностью в широком диапазоне колебаний рН с оптимумом действия при рН 1,5—2,0 и 3,2—4,0. Это обеспечивает гидролиз белков в условиях значительных колебаний концентрации соляной кислоты в желудочном соке, в слоях пищи, прилежащих к слизистой оболочке желудка, и в глубине содержимого желудка.
В желудочном соке представлены семь видов пепсиногенов, объединенных общим названием пепсины. Образование пепсинов осуществляется из неактивных предшественников — пепсиногенов, находящихся в клетках желудочных желез в виде гранул зимогена. В просвете желудка пепсиноген активируется НС1 путем отщепления от него ингибирующего белкового комплекса. В дальнейшем в ходе секреции желудочного сока активация пепсиногена осуществляется аутокаталитически под действием уже образовавшегося пепсина.
При оптимальной величине рН среды пепсин осуществляет гидролиз белков, разрывая в белковой молекуле пептидные связи, образованные группами фениламина, тирозина, триптофана и других аминокислот. В результате этого белковая молекула распадается на пептоны и пептиды. Пепсин обеспечивает гидролиз основных белковых веществ, особенно коллагена — основного компонента волокон соединительной ткани.
К основным пепсинам желудочного сока относятся следующие.
Пепсин А — группа ферментов, гидролизирующих белки при оптимуме рН 1,5—2,0. Часть пепсиногена (около 1%) переходит в кровеносное русло, откуда вследствие небольшого размера молекулы фермента проходит через клубочковый фильтр в почках и выделяется с мочой (уропепсиноген). Определение содержания уропепсина в моче используется в лабораторной практике для характеристики протеолитической активности желудочного сока.
Гастриксин (пепсин С), гидролизирующий белки при оптимуме рН 3,2— 3,5. Пепсин В (парапепсин) расщепляет желатину и белки соединительной ткани. При рН 5,6 и выше протеолитическое действие фермента ослабляется.
Реннин (пепсин Д, химозин) расщепляет казеин молока в присутствии ионов Са2+.
Желудочный сок содержит ряд непротеолитических ферментов. Среди них — желудочная липаза, расщепляющая жиры, которые находятся в пище в эмульгированном состоянии (жиры молока), на глицерин и жирные кислоты при рН 5,9—7,9. У грудных детей желудочная липаза расщепляет до 59 % жира молока. В желудочном соке взрослых людей липазы мало. Поэтому основное количество жиров переваривается в тонком кишечнике.
Клетками поверхностного эпителия слизистой оболочки желудка вырабатывается лизоцим (муромидаза). Лизоцим обусловливает бактерицидные свойства желудочного сока.
Уреаза расщепляет мочевину в желудке при рН 8,0. Освобождающийся при этом аммиак нейтрализует соляную кислоту и предотвращает избыточную кислотность химуса, поступающего из желудка в двенадцатиперстную кишку.
– Также рекомендуем “Желудочная слизь и ее значение. Слизь желудка. Функции желудочной слизи.”
Источник
