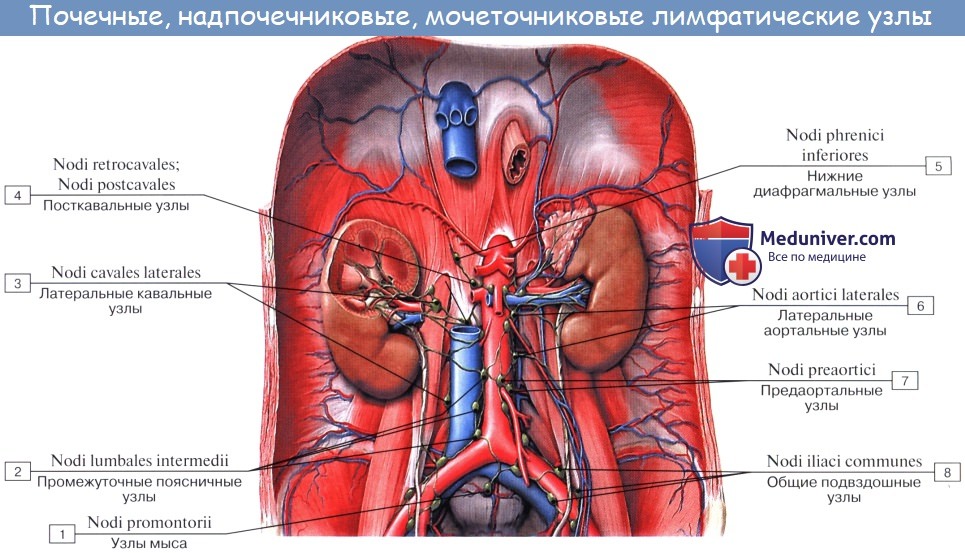
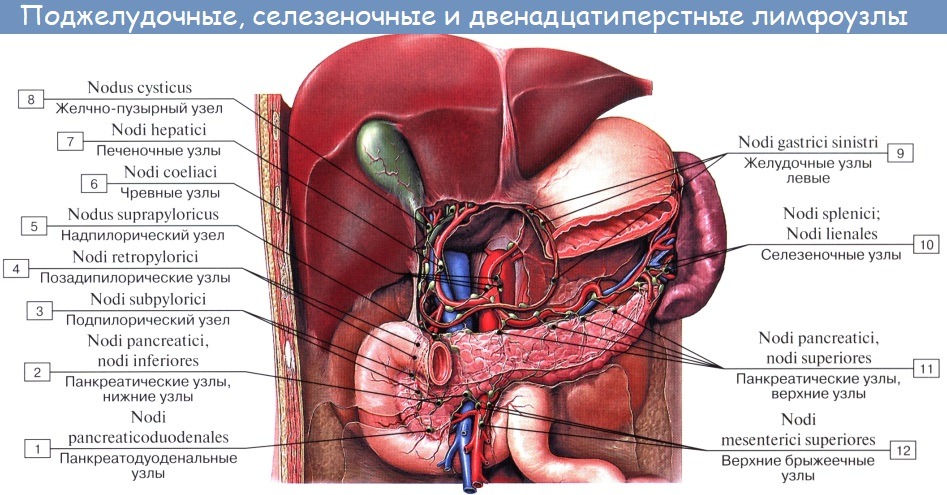
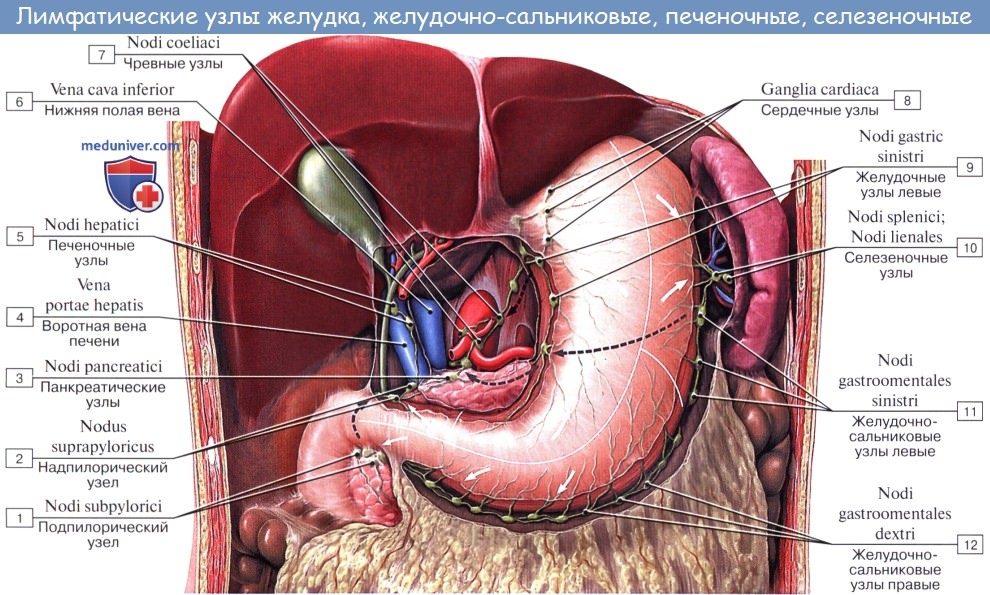
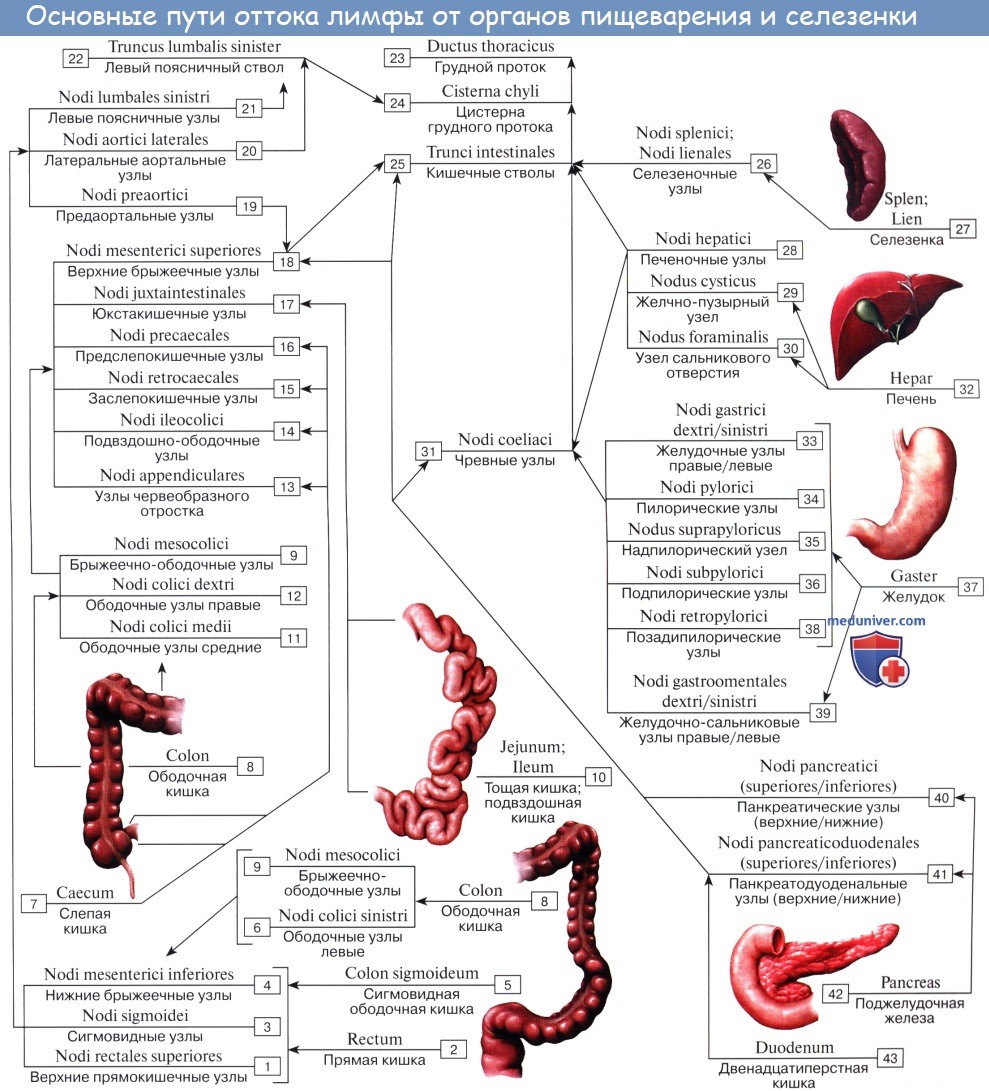
Регионарные лимфатические узлы желудка
Лимфатическая система желудка. Особенности лимфатической системы желудка.
Внутристеночная лимфатическая система желудка распределена во всех его слоях. Лимфатические сосуды желудка образуют в слизистой оболочке капиллярные сети, которые направляются в подслизистый слой, следуя далее в мышечную и серозную оболочки.
Лимфатическая система слизистой оболочки желудка очень богата сплетениями. Через этот слой может широко распространяться раковое поражение желудка. Отводящая лимфатическая система подслизистого слоя образует подслизистые сплетения отводящих сосудов, по которым лимфа поступает в залегающие по ходу артерий лимфатические узлы в направлении, противоположном артериальному кровотоку.
Лимфатическая система желудка очень сложная, явно отличается от лимфатического оттока в кишечнике. В интерстициальной лимфатической системе желудка нет независимых друг от друга областей, все они взаимосвязаны. Имеется некоторая связь между париетальными группами лимфатических узлов. Висцеральная лимфатическая система желудка, гак же как и принимающая от нее лимфу париетальная, на протяжении многих лет служили предметом исследования для Delamere, Poirir и Cuneo, Jamiesou и Dobsou, Coller, Kay и Mclntyre), Rouviere, а в последние годы — для японских ученых.
Как было указано выше, раковое поражение легко распространяется через подслпзистъш слой желудка. Рак верхней трети желудка может переходить на пищевод, где нет защитного барьера от его внедрения. Рак антрального отдела желудка может распространяться на двенадцатиперстную кишку, но не так легко, как с желудка на пищевод. Долгое время считалось, что распространение ракового поражения антрального отдела через пилорическую часть невозможно, так как последняя является защитным барьером от распространения поражения на двенадцатиперстную кишку.
Это ошибочное мнение базировалось на результатах макроскопического изучения удаленных органов и данных рентгенологических исследований. Впоследствии было доказано, что рак антрального отдела может распространяться на двенадцатиперстную кишку через слизистый и подслизистый слои. Поэтому при выполнении резекции желудка по поводу рака следует удалять по крайней мере 3 см проксимальной части двенадцатиперстной кишки.
Знание структуры лимфатической системы определяет оперативную тактику при гастрэктомии по поводу рака. В большинстве хирургических монографий основное внимание уделяется методике выполнения гастрэктомии, но о резекции различных групп лимфатических узлов упоминается в нескольких деталях. Резекцию групп лимфатических узлов следует выполнять по определенной системе, маркируя каждую группу так, чтобы патологоанатом мог идентифицировать их при микроскопическом исследовании. Японские хирурги считают обязательной систематизацию групп лимфатических узлов во время резекции желудка по поводу рака. Было продемонстрировано, что лимфа из всех лимфатических узлов желудка оттекает в чревные лимфатические узлы.
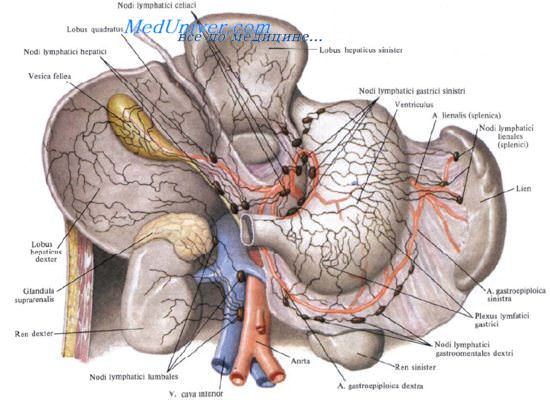
Группы лимфатических узлов желудка описываются следующим образом:
I. Венечные, или левые желудочные, лимфатические узлы.
Собирают лимфу от медиальных двух третей вертикальной части и сегмента горизонтальной части желудка.
II. Селезеночные лимфатические узлы. Собирают лимфу слева и выше от упоминавшейся области, от дна до середины большой кривизны желудка.
III. Печеночные лимфатические узлы.
Отводят лимфу от оставшейся поверхности желудка.
A. Лимфатические узлы в области венечной, или левой желудочной, артерии включают следующие группы:
1. Париетальные лимфатические узлы, расположенные против стенки желудка.
2. Лимфатические узлы, размещенные вокруг кардиальной части желудка: внутренние. наружные и задние кардпальные.
3. Лимфатические узлы малой кривизны желудка, к которым относятся от 3 до 5 узлов расположенных по ходу венечной артерии.
4. Лимфатические узлы серпа венечной артерии, к которым относятся от 2 до 6 узлов вблизи венечной аркады.
5. Чревные лимфатические узлы, расположенные вокруг чревного ствола. Хотя они собирают лимфу не только из венечной области, тем не менее, имеют в ней большое значение.
B. Лимфатические узлы в области селезеночной артерии включают следующие группы:
6. Лимфатические узлы желудочно-селезеночной связки.
7. Лимфатические узлы поджелудочно-селезеночной связки.
8. Лимфатические узлы ворот селезенки.
9. Лимфатические узлы левой желудочно-салниковой артерии.
10. Надподжелудочные (супрапанкреатические) лимфатические узлы, окружающие переднюю поверхность поджелудочной железы выше чревной области.
C. Лимфатические узлы в области печеночной артерии включают следующие группы:
11. Лимфатические узлы, расположенные вокруг правой желудочно-сальниковой артерии над большой кривизной желудка (обычно 5—6 узлов).
12 Интрапилорические лимфатические узлы в количестве от 3 до 6.
13. Позадипилорические лимфатические узлы в количестве 2—3, расположенные по ходу гастродуоденальной артерии.
14. Лимфатические узлы вдоль горизонтальной порции общей печеночной артерии.
15. Лимфатические узлы около вертикальной части собственно печеночной артерии.
16. Надпилорические лимфатические узлы (непостоянны).
17. Передняя панкреатодуоденальная группа лимфатических узлов на передней поверхности поджелудочной железы около передней панкреатодуоденальной аркады.
18. Позадпдуоденальная группа лимфатических узлов по ходу задней панкреатодуоденальной аркады. Передние панкреатодуоденальные лимфатические узлы и узлы, залегающие по ходу правой желудочно-сальнпковой вены, прилегают к верхним брыжеечным сосудам.
– Также рекомендуем “Нервная система желудка. Хирургическая анатомия двенадцатиперстной кишки.”
Оглавление темы “Хирургическая анатомия желудка и двенадцатиперстной кишки.”:
1. Хирургическая анатомия желудка. Формы, стенки и кривизна желудка.
2. Кардиальная часть желудка. Пилорическая часть желудка.
3. Топографическое разделение желудка. Брюшина и связки желудка.
4. Артерии желудка. Левая желудочная или венечная артерия желудка.
5. Печеночная артерия. Топография печеночной артерии.
6. Селезеночная артерия. Венозная система желудка.
7. Лимфатическая система желудка. Особенности лимфатической системы желудка.
8. Нервная система желудка. Хирургическая анатомия двенадцатиперстной кишки.
9. Анатомические варианты двенадцатиперстной кишки. Артерии двенадцатиперстной кишки.
10. Грыжи пищеводного отверстия диафрагмы. Лечение грыжи пищеводного отверстия диафрагмы.
Источник
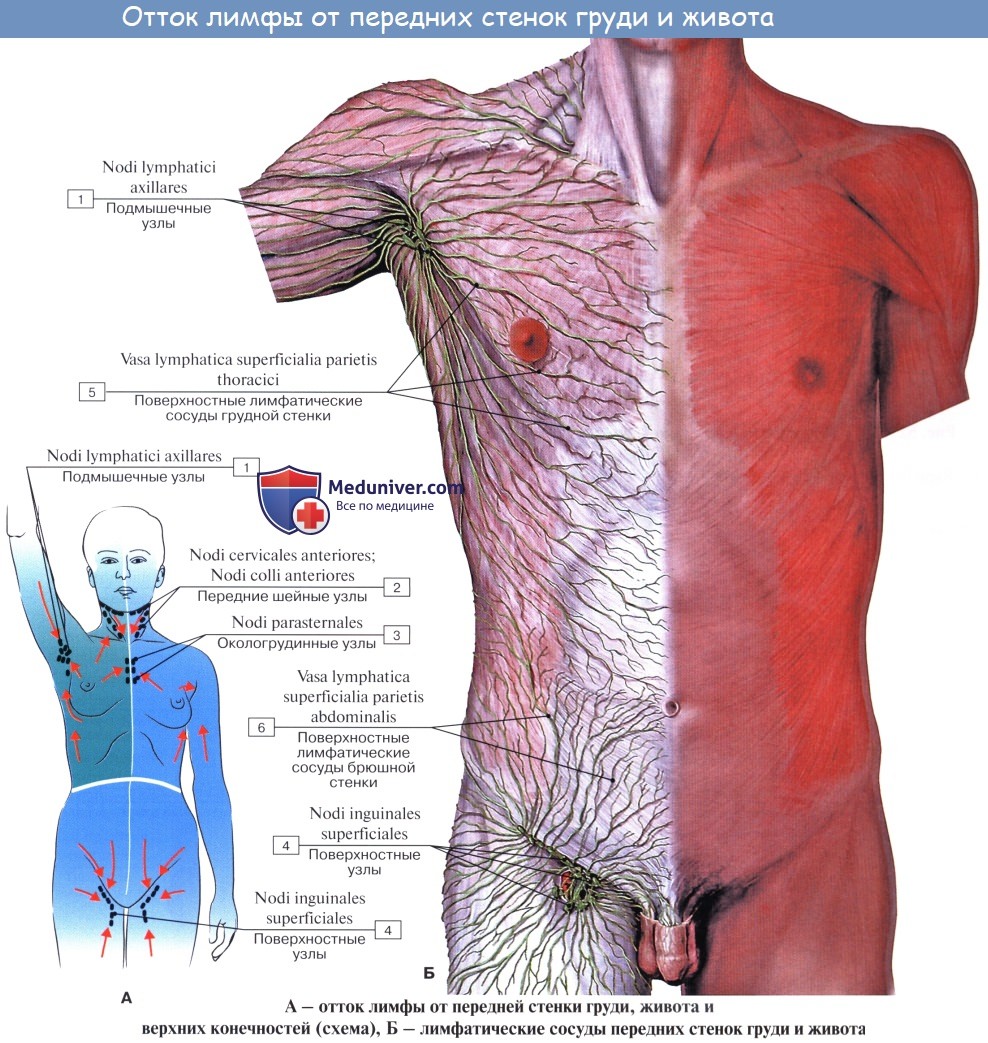
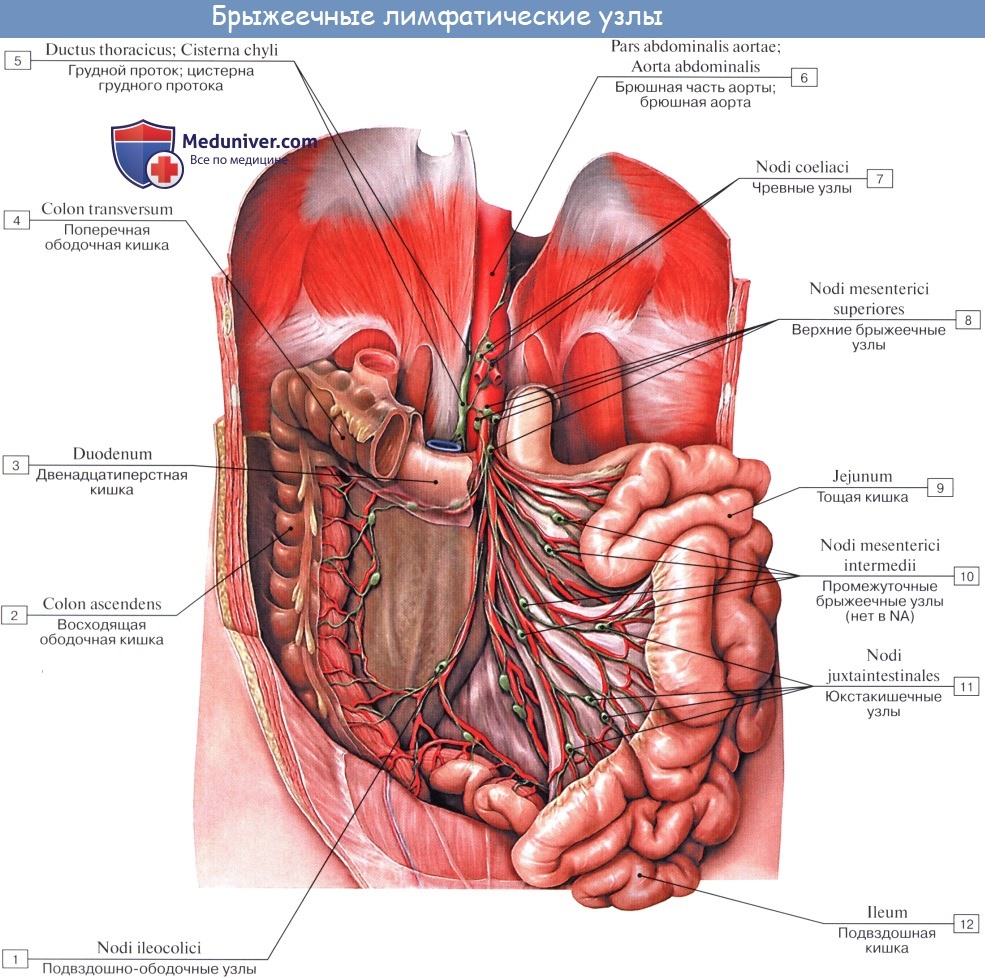
Оглавление темы “Лимфатическая система ( systema Lymphaticum ).”: Лимфатические узлы и сосуды брюшной полости (живота). Топография, строение, расположение лимфатических узлов и сосудов брюшной полости (живота)
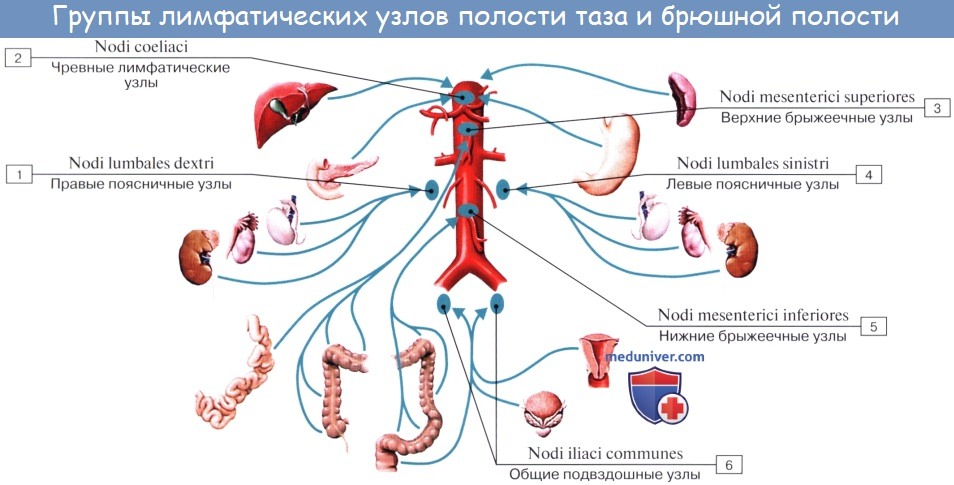
Лимфатические сосуды верхней половины стенки живота направляются вверх и латерально к nodi lymphatici axillares; сосуды нижней половины стенки живота, напротив, спускаются к nodi lymphatici inguinales. В брюшной полости различают: 1) париетальные узлы, залегающие вокруг аорты и нижней полой вены, и 2) висцеральные, которые распределяются вдоль стволов и ветвей чревного ствола, верхней и нижней брыжеечных артерий. Количество париетальных узлов достигает 30 — 50. Общее название этих узлов «поясничные», nodi lymphatici lumbales. Висцеральные узлы брюшной полости распадаются на две большие группы: 1) по ходу ветвей чревного ствола, 2) по ходу ветвей брыжеечных артерий, nodi lymphatici mesenterici superkkes et inferiores. Лимфатические узлы первой группы получают название по отношению к артериям и органам: nodi lymphatici coeliaci, gastrici sinistri et dextri, hepatici, pancreaticoduodenales, pylorici. Вторая группа висцеральных узлов, расположенных вдоль брыжеечных артерий, отличается своей многочисленностью (около 300). Она заложена в толще брыжейки тонкой и толстой кишки и была описана вместе с их лимфатическими сосудами. Впадающие в перечисленные лимфатические узлы лимфатические сосуды органов брюшной полости описаны при изложении анатомии каждого органа (см. «Спланхнология»).
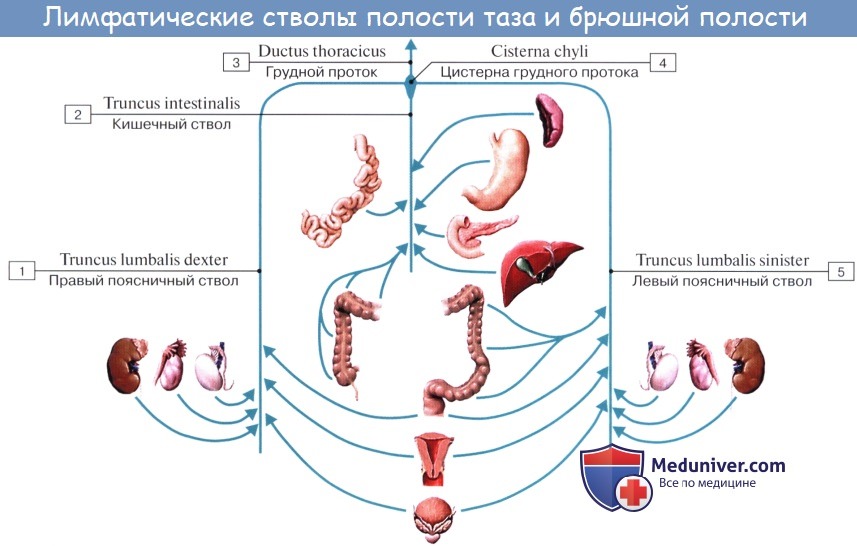
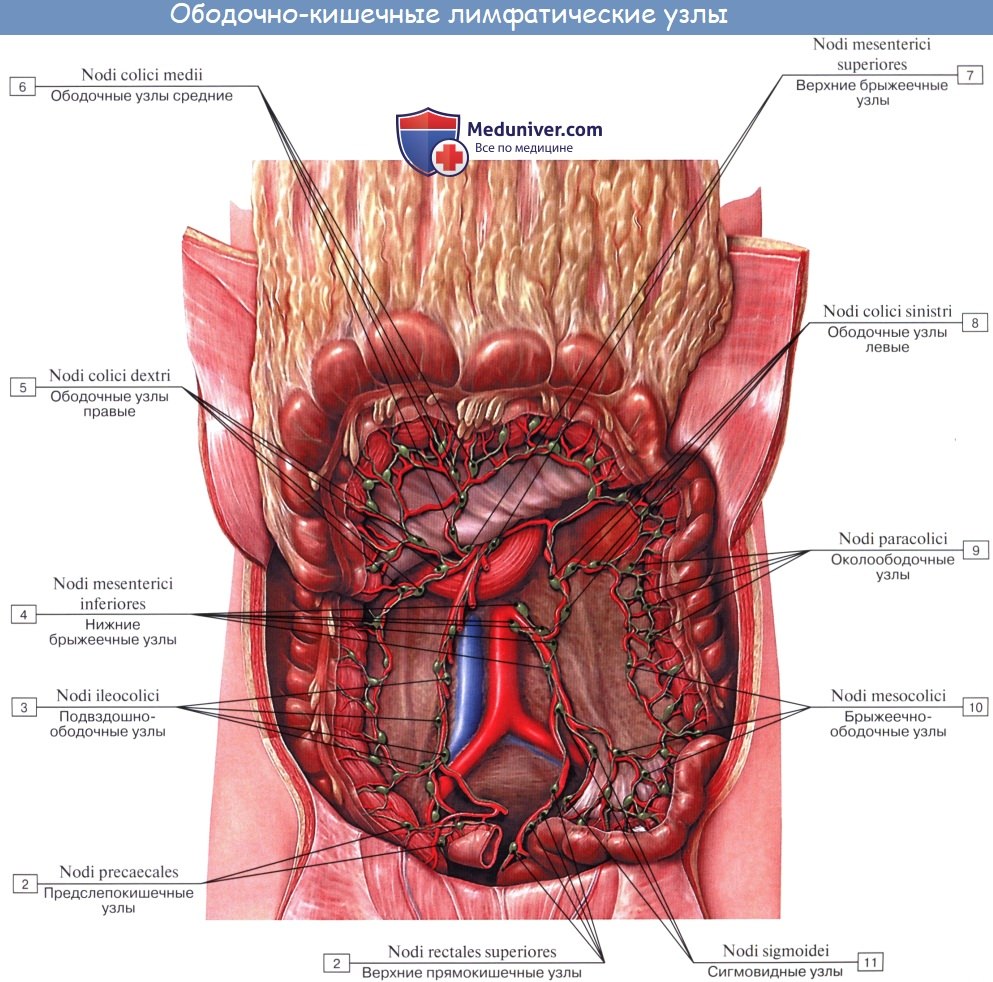
Тонкая кишка имеет особую систему лимфатических сосудов — систему млечных сосудов. Кишка содержит сплетение лимфатических сосудов во всех слоях, составляющих ее стенку: в слизистой, подслизистой, мышечной и серозной. При этом различают две группы лимфатических сосудов: 1. Лимфатические сосуды серозной оболочки. 2. Хилусные, или млечные сосуды (chylus — млечный сок) имеют своими корнями центральные лимфатические сосуды, начинающиеся слепо под эпителием, на вершине ворсинки. Они залегают в слизистой оболочке и подслизистой основе кишки, продолжаясь затем в брыжейку, и транспортируют всасывающийся жир, придающий лимфе вид молочной эмульсии (хилуса), откуда и происходит название этих сосудов (рис. 258). Остальные питательные вещества всасываются венозной системой и уносятся к печени через воротную вену. Отводящие лимфатические сосуды двенадцатиперстной кишки идут к панкреатодуоденальным лимфатическим узлам. Отводящие лимфатические сосуды тощей и подвздошной кишки идут в толще брыжейки к брыжеечным узлам. В брыжейке тонкой кишки следует выделять три группы лимфатических сосудов: 1) левая группа — от начального отрезка тошей кишки (40 — 70 см), 2) средняя группа — от остальной части тощей кишки и 3) правая группа — от подвздошной кишки. Проходя в брыжейке, млечные сосуды прерываются брыжеечными лимфатическими узлами, расположенными в четыре ряда. Узлы первого ряда расположены вдоль брыжеечного края кишки, узлы второго — несколько отступя от края, узлы третьего — около корня брыжейки и узлы четвертого — в корне брыжейки. Из брыжеечных узлов лимфа течет к поясничным узлам, а оттуда в truncus lumbalis sinister и далее в грудной проток. Иногда часть выносящих сосудов брыжеечных и других висцеральных узлов брюшной полости собирается в короткие стволы, называемые trunci intestinales, которые впадают или непосредственно в начало грудного протока, или в левый (редко в правый) поясничный ствол. Из толстой кишки лимфоотток происходит в nodi lymphatici ileocolici, colici dextri, colici medii, mesenterici inferiores, colici sinistri, расположенные по ходу одноименных сосудов.
– Также рекомендуем “Лимфатические узлы и сосуды грудной клетки. Топография, строение, расположение лимфатических узлов и сосудов грудной клетки.” |
Источник
РАННИЙ РАК ЖЕЛУДКА (рТ1): ФАКТОРЫ ПРОГНОЗА,
ЗАКОНОМЕРНОСТИ ЛИМФОГЕННОГО МЕТАСТАЗИРОВАНИЯ, РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
В.Ю. Скоропад, Б.А. Бердов
Медицинский Радиологический Научный Центр РАМН, Обнинск
Определение раннего рака желудка было впервые дано Японским обществом гастроэнтерологической эндоскопии в 1962 г. К нему были отнесены опухоли, ограниченные пределами слизистого или подслизистого слоев стенки желудка вне зависимости от наличия метастазов в регионарные лимфатические узлы. Основаниями для выделения раннего рака желудка (рТ1) в противовес местно-распространенному (рТ2-4) явились полученные японскими исследователями исключительно благоприятные отдаленные результаты хирургического лечения этой категории больных. Концепция «раннего рака желудка» существует в неизменном виде уже более 40 лет и поддерживается большинством исследователей. В то же время, ряд авторов предлагает свою трактовку понятия раннего рака желудка, суживающую данную категорию больных за счет ограничений по глубине инвазии, размеру опухолевого поражения и наличию метастазов в регионарные лимфатические узлы.
Отдаленные результаты хирургического лечения раннего рака желудка, по данным различных авторов, варьируют весьма широко: 5-летняя выживаемость колеблется от 64% до 100%, 10-летняя выживаемость – от 62% до 98%. Причины столь значительных различий связаны, в первую очередь, с неоднородностью групп, то есть различным в каждой авторской серии соотношением больных в зависимости от глубины опухолевой инвазии, состояния регионарных лимфатических узлов и других клинико-морфологических факторов. Насколько часто встречается ранний рак желудка и является ли эта проблема действительно актуальной? Если в 50–80-е годы ХХ века в США, Австралии и Европейских странах доля раннего рака желудка среди радикально оперированных больных измерялась несколькими процентами, то к началу ХХI века она вплотную приблизилась или даже превысила 20%.
Частота метастазирования в лимфатические узлы при раннем раке желудка варьирует весьма широко – от 5,5% до 43%, но по данным абсолютного большинства авторов находится в пределах 10-20% . Это означает, что более чем у 80% больных объем операции – гастрэктомия и субтотальная резекция желудка со стандартной либо расширенной лимфаденэктомией – превышает достаточный с точки зрения достижения радикальности. У больных ранним раком желудка без метастазов в регионарные лимфатические узлы адекватным лечением может быть выполнение органосберегающих операций либо эндоскопических вмешательств.
Пристальное внимание к концепции раннего рака желудка связано также с попыткой достижения второй важнейшей цели лечения онкологических больных – более высокого качества жизни. В связи с этим выбор адекватного метода лечения является предметом активной дискуссии в мировой литературе.
Мы располагаем опытом хирургического лечения 920 больных раком желудка, среди них у 149 (16,2%) больных опухоль была ограниченна пределами слизистого или подслизистого слоев стенки желудка (Т1 в соответствии с 5-ым изданием классификации TNM и 2-ым английским изданием Японской классификации рака желудка).
Гастрэктомия была выполнена у 23 (15%) больных, дистальная субтотальная резекция желудка – у 98 (66%) больных, проксимальная субтотальная резекция желудка – у 3 (2%) больных. Во всех эти случаях единым блоком с желудком удалялись оба сальника, а также клетчатка вдоль левой желудочной артерии. У 21 (14%) больного была выполнена дистальная резекция желудка с неполным удалением перигастральных лимфатических узлов. Такой объем оперативного вмешательства использовали при наличии небольшого размера поверхностных опухолей пилорического отдела желудка.
Мы наблюдали статистически значимый рост частоты раннего рака желудка среди радикально оперированных больных с 7,7% в 70-е годы до 22,2% в 90-е годы и в настоящее время. Среди 149 больных было 87 мужчин и 62 женщины. Возраст больных колебался от 29 до 78 лет, составив в среднем 55 лет. Преобладающей локализацией опухоли были нижняя (61%) и средняя (26%) трети желудка. У половины больных опухоли имели размеры до 2 см, в том числе у 34 (23%) пациентов – менее 1 см. В то же время, у каждого десятого больного максимальный размер новообразования превышал 6 см, а у 9 (6%) больных – превышал 10 см. Среди макроскопических форм роста возвышающиеся и плоские опухоли встречались с одинаковой частотой (24% и 23%); углубленные или изъязвленные – почти в два раза чаще (44%). Инфильтративный рост (4 тип по классификации Borrmann) имел место у 14 больных и наблюдался статистически значимо чаще при прорастании опухолью подслизистого слоя: 13% и 3% соответственно (р=0,0456). Изучение морфологического строения показало, что в 56% наблюдений опухоли были представлены высоко- и умеренно дифференцированной аденокарциномой; в 44% – низкодифференцированной аденокарциномой, перстневидно-клеточным и недифференцированным раком. Мультицентрический рост опухоли является одним из основных аргументов противников выполнения экономных резекций и эндоскопического лечения раннего рака желудка. По данным различных авторов два и более очага опухолевого поражения наблюдаются у 4-17% больных (в среднем – у 7-8%), причем, как правило, в пределах одной анатомической области. В нашем исследовании у 5 (3%) больных были выявлены две опухоли в одном (4 случая) и различных (1 случай) отделах желудка.
Среди 149 больных в 60 (40%) случаях опухоль располагалась на уровне слизистого слоя стенки желудка, а в 89 (60%) случаях – прорастала подслизистый слой. Среди больных с инвазией только слизистой оболочки ни в одном случае не были обнаружены метастазы в лимфатические узлы; при прорастании опухолью подслизистого слоя регионарные метастазы были выявлены у 18 (20%) больных. Частота метастатического поражения регионарных лимфатических узлов при раннем раке желудка (рТ1) по данным различных авторов варьирует от 5,5% до 43%; при прорастании слизистого слоя – от 0% до 5%, при прорастании подслизистого слоя – от 9,6% до 26%. Количество пораженных лимфатических узлов в нашем исследовании варьировало от 1 до 7, и в среднем составило 2,7. Метастазы обнаруживали в следующих группах лимфатических узлов: малого сальника (11 больных), большого сальника (4), вдоль левой желудочной артерии (4), надпривратниковых (1), подпривратниковых (1). Таким образом, у большинства больных (п=14, 78%) метастазы локализовались только в перигастральных лимфатических узлах (N1 в соответствии с Японской классификацией рака желудка); в 4 случаях – в лимфатических узлах второго коллектора (N2). По данным различных авторов, метастазы в перигастральные лимфатические узлы обнаруживаются в 75-80% случаев и более; во втором лимфатическом коллекторе – в 20-25%; в более отдаленных (N3-4) – в единичных наблюдениях.
Локализация первичной опухоли оказывала существенное влияние на риск развития лимфогенных метастазов. Так, при локализации опухоли в нижней трети желудка метастазы в регионарные лимфатические узлы были обнаружены у 12% больных, а при локализации в средней, верхней третях и при тотальном поражении желудка – в 31% (различие статистически значимо, р=0,03). Наиболее часто метастазы имели место при тотальном поражении желудка – у 3 из 6 больных (50%). Локализация опухоли влияла и на количество пораженных лимфатических узлов. Так, если при локализации опухоли в нижней трети желудка наличие двух и более пораженных лимфатических узлов имело место у 2 из 7 больных (29%), то при локализации опухоли в более проксимально расположенных отделах – у 7 из 11 больных (64%). Многофакторный анализ с использованием метода логистической регрессии определил локализацию опухоли как независимый прогностический фактор лимфогенного метастазирования. Частота лимфогенного метастазирования закономерно росла с увеличением размера опухоли. В тех случаях, когда диаметр опухоли не превышал 2 см, метастазы в лимфатические узлы определялись у 11% больных; при размере опухоли от 2 до 4 см – у 18% больных; при размерах более 4 см – у 33% больных. Различие между группами «4 см» статистически значимо (р=0,05). При минимальном размере опухоли (≤1 см) метастаз в лимфатическом узле был обнаружен лишь в одном наблюдении. Закономерности метастатического поражения лимфатических узлов второго коллектора (зоны чревного ствола и его ветвей) в мировой литературе освещены явно недостаточно. В основном это объясняется тем, что их поражение наблюдается лишь у 1-3,5% больных ранним раком желудка, в том числе в 3-7% случаев при прорастании первичной опухолью подслизистого слоя и в единичных случаях при внутрислизистых опухолях. По данным Tsujitani и соавт., метастазы в лимфатические узлы второго эшелона имели место у 15 из 890 (1,7%) больных и только в тех случаях, когда опухоли были более 2 см в диаметре и имели углубленный характер роста. В наших наблюдениях метастазы в лимфатические узлы второго коллектора лимфооттока имели место у 4 из 156 (2,6%) больных ранним раком желудка, в том числе у 4,3% – при прорастании подслизистой оболочки. Однако какой-либо закономерности в их развитии проследить не удалось – размеры первичной опухоли варьировали от 0,8 до 6,5 см; тип роста был как приподнятый, так и углубленный; степень дифференцировки – G1 и G3.
Из 148 оперированных и выписанных из стационара больных умерли 47; 26 больных умерли от причин, не связанных с основным заболеванием; 5 больных умерли от метахронных злокачественных новообразований (рака легкого, рака яичников, рака ободочной кишки, рака мочевого пузыря и острого лейкоза). У 7 больных причина смерти не известна; 14 больных умерли от рецидива рака желудка; у большинства из них (12 больных) имели место гематогенные метастазы. Локо-регионарный рецидив был выявлен у 6 больных и только в 2 случаях – изолированный (оба больных были радикально оперированы, произведена экстирпация культи желудка). Длительность безрецидивного периода варьировала значительно: от 2-6 месяцев (4 больных) до 109-112 месяцев (2 больных).
Показатели общей 5-, 10- и 15-летней выживаемости всей исследуемой группы больных составили 78%, 64% and 48% соответственно; медиана выживаемости – 15 лет. Скорректированная по причине смерти выживаемость была статистически значимо выше (χ2=8,196; df=l; р=0,0042). Выявлены два фактора, статистически значимо снижающих оба вида выживаемости: прорастание опухолью подслизистого слоя стенки желудка и метастатическое поражение регионарных лимфатических узлов. По данным различных авторов, 5-летняя выживаемость при прорастании опухолью слизистого слоя составляет 91-94%, подслизистого слоя – 78-83%, при отсутствии метастазов в регионарные лимфатические узлы – 85-100%, при наличии метастазов в регионарные лимфатические узлы – 64-81%. Поскольку метастазы в лимфатические узлы наблюдались только при поражении опухолью подслизистого слоя, мы сравнили выживаемость больных в зависимости от глубины инвазии опухолью стенки желудка при отсутствии регионарных метастазов. Оказалось, что статистически значимые различия (в пользу опухолей в пределах слизистого слоя) сохраняются по критерию общей выживаемости (χ2=8,834; df=l; р=0,003) и отсутствуют по критерию скорректированной выживаемости (χ2=2,775; df=1; р=0,0958).
Нами не выявлено статистически значимых отличий в результатах лечения в зависимости от локализации, морфологического строения, размера и макроскопического типа роста опухоли, а также вида оперативного вмешательства. При прорастании опухоли в пределах слизистого слоя только один больной умер от морфологически подтвержденного рецидива – множественных гематогенных и перитонеальных метастазов через 112 месяцев после оперативного лечения. Принимая во внимание очень низкую вероятность лимфогенного метастазирования и хорошие отдаленные результаты (15-летняя общая выживаемость – 80%, скорректированная выживаемость – 93%) мы считаем, что субтотальная резекция с ограниченной (D1) лимфаденэктомией является адекватным хирургическим вмешательством. Определенные подгруппы больных (небольшие по размеру опухоли при отсутствии мультицентрического роста) могут рассматриваться как кандидаты для более консервативного лечения – выполнения сегментарных операций, а также эндоскопического удаления опухоли. Преимущество органосберегающего лечения очевидно – улучшение качества жизни, более полная медицинская, социальная и трудовая реабилитация больных.
Отдаленные результаты лечения больных при прорастании опухоли в подслизистый слой были значительно хуже, и связано это, в первую очередь, с метастатическим поражением лимфатических узлов. 5 из 18 (28%) больных, имевших регионарные метастазы, умерли от рецидива заболевания. Принимая во внимание больший размер, чаще выявляемую мультицентричность поражения, более высокую частоту лимфогенного метастазирования, включая поражение лимфатических узлов второго и даже третьего коллектора, мы считаем, что лечение опухолей с распространением на подслизистый слой должно быть таким же, как и более распространенных форм рака желудка. Небольшой размер и экзофитный рост опухоли не могут быть основанием для ограничения объема вмешательства, поскольку напрямую не коррелируют с глубиной инвазии и наличием метастазов в лимфатические узлы. Однако, остается неясным, способно ли расширение объема оперативного вмешательства улучшить отдаленные результаты лечения, поскольку причиной смерти большинства больных были отдаленные метастазы. Более того, мы наблюдали 5 больных, умерших от множественных гематогенных метастазов в течение первого года (через 2,3,4, 6 и 10 месяцев) после операции. Полученные нами данные о преобладании гематогенного пути метастазирования раннего рака желудка, а также о высокой частоте развития рецидивов после хирургического лечения опухолей с инвазией подслизистого слоя и наличием метастазов в регионарные лимфатические узлы соответствуют данным других исследователей. Это означает, что даже ранние опухоли желудка могут иметь высокую биологическую агрессивность, и отдаленные метастазы могут быть уже к моменту выполнения операции. Частота развития рецидивов у больных раком желудка рТ1N+ в нашем исследовании (5 из 18 больных) соответствует аналогичному показателю в работах Abe S. и соавт. и Kitamura К. и соавт., хотя японские авторы рутинно использовали расширенную лимфодиссекцию. В двух крупных европейских рандомизированных исследованиях также не было показано преимуществ расширенной (D2) лимфаденэктомии по сравнению с ограниченной (D1) при опухолях Т1.
В заключение следует отметить, что практически все аспекты проблемы раннего рака желудка (определение, клинико-морфологические характеристики, выбор адекватного метода лечения и его результаты, факторы прогноза) продолжают оставаться предметом полемики. Полученные нами данные убедительно демонстрируют, что так называемый “ранний”, “поверхностный”, “начальный” или “малый” рак желудка с распространением только в пределах слизистого или подслизистого слоев представляет собой весьма разнородную группу опухолей. Они значительно отличаются по морфологической форме, особенностям роста в пределах стенки желудка, потенции давать лимфогенные и гематогенные метастазы, и, соответственно, по прогнозу. Так, опухоли с поражением подслизистого слоя, по сравнению с расположенными только в пределах слизистого слоя, статистически значимо больше по размеру, чаще имеют низкую степень дифференцировки, мультицентрический рост, и, главное, значительно чаще метастазируют в регионарные лимфатические узлы. Очевидно, что закономерности лимфогенного метастазирования являются краеугольным камнем в дискуссии о выборе адекватного лечения раннего рака желудка. Опухоли, расположенные на уровне слизистой оболочки стенки желудка, наиболее полно отвечают понятию раннего рака, поскольку практически не метастазируют в лимфатические узлы. Поэтому органосохраняющее лечение у данной категории больных может рассматриваться как адекватное с онкологических позиций. При прорастании опухолью подслизистого слоя, частота лимфогенных метастазов достигает 20-25%, а с учетом наличия микрометастазов повышается еще более. Дальнейший прогресс в лечении больных ранним раком желудка связан с индивидуализацией объема оперативного вмешательства на пораженном органе и лимфатическом аппарате. В последние годы появились позитивные результаты исследований, посвященных применению концепции сторожевых лимфатических узлов у больных раком желудка, что впервые открывает возможность индивидуальной оценки состояния регионарных лимфатических узлов. Проведенные исследования показали, что общая диагностическая точность оценки статуса регионарных лимфатических узлов на основании биопсии сторожевых лимфатических узлов весьма высока и составляет 90-98%. Интраоперационное (в том числе во время лапароскопического вмешательства) морфологическое исследование сторожевых лимфатических узлов может позволить обоснованно отобрать группу больных ранним раком желудка, у которых отсутствуют регионарные метастазы, для выполнения органосберегающих оперативных вмешательств. По нашему мнению, в настоящее время методом оперативного лечения рака желудка с распространением на подслизистый слой должна быть гастрэктомия либо дистальная субтотальная резекция желудка с модифицированной D2 лимфодиссекцией – удалением лимфатических узлов вдоль чревной, левой желудочной, общей печеночной и проксимальной части селезеночной артерии, и сохранением селезенки и поджелудочной железы.
![]()
![]()
![]()
![]()
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник