Рак желудка кровотечение лечение

Рак желудка – злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения – хирургический, удаление всего желудка или его пораженной части.
Причины рака желудка
Точные причины рака желудка неизвестны. В слизистой оболочке органа возникают мутации ДНК, и получаются «неправильные» клетки, которые могут приобрести способность к неконтролируемому росту. Почему это происходит — не совсем понятно. Зато хорошо изучены факторы риска — условия, которые повышают риск рака желудка.
Наследственность и рак желудка
Некоторые люди носят в себе «бомбу замедленного действия», спрятанную в генах. Иногда даже не одну. Это подтверждается некоторыми фактами:
- Если у близкого родственника (родители, братья, сестры, дети) человека диагностирован рак желудка, его риски повышены примерно на 20%.
- Мужчины болеют чаще, чем женщины. Сложно сказать, с чем конкретно это связано, но можно предположить, что замешана разница между мужскими и женскими генами.
- Японцы, которые мигрировали в США, болеют раком желудка реже соотечественников, но чаще, чем «коренные» американцы. Это говорит о том, что дело не только в характере питания, но и в наследственности. Главный подозреваемый — ген под названием RNF43.
- Карцинома — самый распространенный тип рака желудка — чаще встречается у людей с группой крови A (II), которую они, конечно же, получили вместе с генами.
- Риски повышены при некоторых наследственных заболеваниях: злокачественной анемии (в 3-6 раз), гипогаммаглобулинемии, неполипозном раке толстой кишки.
- Заболеваемость раком желудка повышается после 70 лет: считается, что это происходит из-за того, что с возрастом в клетках тела накапливаются нежелательные мутации.
Рак желудка и характер питания
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Рак желудка и вредные привычки
Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
Хеликобактер пилори (H. Pylori) и рак желудка
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
Другие факторы риска
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз – заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
- Кишечный. Как следует из названия, в окружении опухоли имеется кишечная метаплазия, то есть слизистая оболочка желудка становится похожа на слизистую кишечника. Этот тип рака чаще встречается у пожилых людей, отличается более благоприятным прогнозом. Это типично «японский» тип рака.
- Диффузный. Опухолевые клетки расползаются по стенке желудка, они окружены нормальной слизистой оболочкой.
- Смешанный.
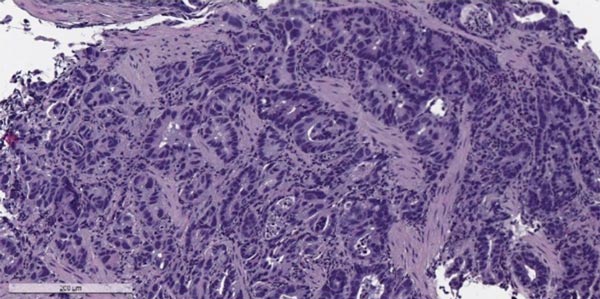
Аденокарцинома желудка
Стадии рака желудка
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx – первичную опухоль невозможно оценить;
- T0 – первичная опухоль не обнаруживается;
- T1 – тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки (“рак на месте”);
- T2 – опухоль проросла в мышечный слой стенки органа;
- T3 – рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 – опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx – невозможно оценить метастазы в лимфатических узлах;
- N0 – метастазы в регионарных лимфоузлах не обнаружены;
- N1 – поражены 1-2 лимфоузла;
- N2 – опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 – метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 – отдаленные метастазы не обнаружены;
- M1 – обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 – стадия Ia; T1N1M0, T2N0M0 – стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 – стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 – стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 – стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 – стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 – стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
На ранних стадиях рак желудка либо не имеет симптомов вообще, либо маскируется под другие заболевания: гастрит, обострение язвенной болезни. Ухудшение аппетита и боли под ложечкой редко заставляют людей сразу же подозревать онкозаболевание и бежать в больницу. Обычно ограничиваются диетой и приемом разрекламированных таблеток «от желудка». Если человек уже страдает язвенной болезнью, он может воспринять первые признаки рака желудка как очередное обострение язвы. И уже позже, когда диагностировано онкологическое заболевание, больной вспоминает, что проявления были «не такими, как всегда».
Существует так называемый «синдром малых признаков» — его сформулировал один из основоположников советской онкологии, Александр Иванович Савицкий. Если беспокоят похожие симптомы — это повод сходить к врачу и провериться:
- Необъяснимая слабость и повышенная утомляемость.
- Плохой аппетит.
- Снижение работоспособности.
- Потеря веса.
- «Желудочный дискомфорт»: неприятные ощущения, из-за которых даже любимая еда больше не радует.
В дальнейшем нарастают более яркие, «кричащие» признаки. Они зависят от того, в какой части органа находится опухоль:
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Со временем в опухоли начинаются процессы изъязвления и распада, развивается желудочное кровотечение. Проявляется оно в виде черного дегтеобразного стула, рвоты, которая выглядит как «кофейная гуща» или содержит примеси алой крови. Если человек теряет много крови, он становится бледным, возникает слабость, головокружение. У некоторых людей рак диагностируется, когда их приводят в клинику в таком состоянии на машине «Скорой помощи».
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В клиниках «Евроонко» существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.
Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака – Япония, во многом за счет характера питания.
В клиниках «Евроонко» применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
Цены на лечение рака желудка на 1-4 стадиях
- Консультация онколога — 5100 руб.
- Лечение рака желудка — от 60000 руб.
- Проведение внутриплевральной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 21900 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 17200 руб.
Источник
В настоящее время во всем мире одним из самых распространенных онкологических заболеваний (второй после рака легкого) является рак желудка, от которого ежегодно погибают более 500 тыс. человек [1—3]. Несмотря на тенденцию к снижению частоты этого заболевания, в ряде развитых стран Азии, таких как Япония, Южная Корея, Китай, за последние 3—4 десятилетия своевременная диагностика и радикальное лечение рака желудка остаются актуальной и социально значимой проблемой [3, 4].
Прогрессирование рака желудка связано не только с ранней лимфогенной и перитонеальной диссеминацией, а также с обширным местным распространением с вовлечением в опухолевый процесс окружающих органов и тканей. Прорастание раковой опухоли в стенку желудка зачастую приводит к ее некрозу и аррозии крупного питающего стенку сосуда, что создает условия для появления ряда серьезных осложнений — перфораций и кровотечений, которые могут стать причиной смерти больного [4, 5].
Несмотря на развитие современной онкологии, модернизацию медицинских технологий, удельный вес взятых на учет больных с I—II стадией рака желудка не превышает 25,3% [3]. Около 75% больных поступают в специализированные учреждения с запущенной III—IV стадией процесса [1, 2]. При этом у большинства пациентов имеют место различные осложнения, диктующие необходимость выполнения срочной хирургической коррекции. Из них наиболее часто встречаются кровотечение, стеноз, а в некоторых случаях и туморозная перфорация с развитием перитонита. В этих случаях в связи с местной распространенностью патологического процесса, соответствующей III—IV стадии, адекватное хирургическое вмешательство представляет собой чрезвычайно трудную задачу [6, 7].
Выбор клинической стратегии в лечении местно-распространенного рака желудка, осложненного кровотечением, зависит от многочисленных факторов, включающих в себя тяжесть состояния больного, объем кровопотери, оснащенность стационара современным медицинским оборудованием и квалификации персонала.
В настоящее время в литературе в отношении подходов к лечению местно-распространенного рака желудка, осложненного кровотечением, представлены три основные точки зрения [8, 9]:
1) выполнение радикальных расширенных хирургических вмешательств;
2) проведение паллиативных операций;
3) консервативная тактика, основанная на проведении эндоскопических гемостатических мероприятий/рентгенэндоваскулярных вмешательств, одновременно с гемостатической и крововозмещающей терапией.
На сегодняшний день особо актуальной является проблема хирургического лечения местно-распространенного рака желудка III—IV стадии, частота которого среди всех вновь выявленных больных с данной нозологической формой колеблется, по данным разных авторов, от 20 до 60% [10, 11]. Радикальные вмешательства в отношении таких больных, по мнению разных авторов, выполняются в 19—53,6% случаев [3, 12, 13]. Даже после потенциально радикальных операций большинство больных местно-распространенным раком желудка погибают от прогрессирования и рецидива опухоли [6, 14].
Паллиативным методом хирургического вмешательства у больных местно-распространенным раком желудка, осложненным кровотечением, является перевязка питающей опухоль артерии [2, 13], а прошивание кровоточащей опухоли необоснованно и бесперспективно из-за неэффективности и развития рецидивов кровотечения [9, 15]. Зачастую при рецидивах профузного желудочного кровотечения возникает необходимость в выполнении паллиативных операций — субтотальной резекции желудка или гастрэктомии.
Ведущую и значимую роль в диагностике рака желудка играет гастроскопия. В 95% случаев проведение эндоскопического исследования позволяет подтвердить диагноз:
1) описать макроскопический вид и характер роста опухоли;
2) уточнить размер и локализацию;
3) выполнить биопсию для гистологической верификации;
4) провести комбинированный гемостаз.
В специализированных лечебных учреждениях для остановки кровотечения из опухоли желудка в последние годы стали использовать регионарный рентгеноэндоваскулярный гемостаз. Этот метод лечения показан больным при неэффективности эндоскопического гемостаза и в случае высокого операционного риска вследствие тяжелой сопутствующей патологии либо распространенности опухолевого процесса. В этих случаях применяют такие способы эндоваскулярного гемостаза, как селективное введение вазоконстрикторов или эмболизацию афферентного сосуда. Ангиографические лечебные процедуры при злокачественных новообразованиях желудочно-кишечного тракта используют нечасто [9, 15, 16] в связи с высоким риском ишемического стеноза или перфорации полого органа, имеющего только артериальный источник кровоснабжения, а также техническими трудностями катетеризации небольших по диаметру питающих артерий.
Показания к внутрисосудистым вмешательствам можно сформулировать следующим образом [2, 5]:
1) необходимость остановки кровотечения из опухоли;
2) предоперационная подготовка;
3) регионарная химиотерапия;
4) паллиативное лечение.
Больной С., 71 год, страдающий язвенной болезнью желудка в течение длительного времени, в декабре 2016 г. был экстренно оперирован по поводу перфоративной язвы желудка. Выполнена лапаротомия, перфоративное отверстие желудка ушито, биопсию не выполняли. В апреле 2017 г. поступил в экстренном порядке в хирургическую клинику Боткинской больницы с клинической картиной желудочного кровотечении, которая проявилась меленой и артериальной гипотензией (АД до 90/60 мм рт.ст.). При поступлении гемоглобин 72 г/л, эритроциты 2,9∙1012/л. С учетом тяжести состояния больной был госпитализирован в реанимационное отделение, где ему выполнили эзофагогастродуоденоскопию (ЭГДС) (рис. 1). Рис. 1. Рак антрального отдела желудка. Инфильтративно-язвенная форма. Виден тромб-сгусток в дне язвы (ЭГДС).
Протокол. Аппарат под контролем зрения проведен в пищевод. Слизистая оболочка его бледно-розовая, гладкая. Кардия смыкается. В желудке умеренное количество алой и измененной крови, сгустков темного цвета. Содержимое эвакуировано. Слизистая оболочка тела желудка, доступная осмотру в области свода, а также по передней, задней стенкам и малой кривизне, бледная. Отмечается деформация просвета антрального отдела желудка с переходом на угол и частично дистальный отдел нижней трети тела за счет инфильтрации слизистой. Слизистая стенки антрального отдела желудка имеет неровную бугристую поверхность с неглубокими дефектами, покрытыми фибрином и плотнофиксированными мелкими сгустками темного цвета. На фоне инфильтрации слизистой антрального отдела по малой кривизне с переходом на заднюю стенку определяется средней глубины дефект неправильной формы размерами 3,0&s;3,5 см. Дно дефекта представлено плотной инфильтрированной тканью с налетами фибрина, гематина и плотно фиксированным сгустком темного цвета, из-под которого подтекает алая кровь. Выполнена биопсия. Ткань ригидная. Аппарат диаметром 0,9 см за зону деформации пилорического канала проходит с техническими трудностями. В просвете двенадцатиперстной кишки — измененная кровь без сгустков с примесью желчи. Слизистая оболочка постбульбарного отдела бледная, эластичная, без видимых дефектов на момент осмотра. Большой дуоденальный сосок не визуализируется. Заключение. Рак антрального отдела желудка с признаками продолжающегося кровотечения и стенозирования.
Выполнен эндоскопический гемостаз бесконтактным методом с использованием аргонно-плазменной коагуляции. Установлен назоинтестинальный зонд в двенадцатиперстную кишку для энтерального питания.
Результат морфологического исследования: умеренно-дифференцированная аденокарцинома желудка с распадом.
В отделении больному проводили гемостатическую, инфузионную терапию, энтеральное питание. Дообследован на предмет распространенности онкологического процесса. При компьютерной томографии с внутривенным контрастированием органов брюшной и грудной полости выявлено утолщение стенок желудка в антральном отделе на протяжении 4 см, лимфаденопатия брюшной полости с подозрением на регионарное метастазирование в области лимфоузлов 3, 4 и 5-й групп; признаков отдаленных метастазов не обнаружено. По результатам эндоскопического сканирования диагностировано поражение стенки желудка до серозного слоя и увеличение лимфоузлов в области 3, 4 и 5-й групп.
При ЭХО-КГ сердца выявлена умеренная гипертрофия миокарда левого желудочка. Незначительная дилатация левого и правого предсердий. Систолическая функция сохранена, фракция выброса 60%. Нарушение диастолической функции левого желудочка 1-го типа. Незначительная легочная гипертензия. Ультразвуковое ангиосканирование сосудов нижних конечностей (неокклюзивный тромбоз суральной вены левой голени).
На основании данных, полученных при комплексном обследовании, установлен диагноз: «Умеренно-дифференцированная аденокарцинома антрального отдела желудка T4NхM0. ECOG 2. Осложнение основного заболевания: состоявшееся желудочное кровотечение, постгеморрагическая анемия средней степени тяжести, субкомпенсированный стеноз выходного отдела желудка».
Несмотря на проводимую гемостатическую комплексную терапию, на 12-е сутки развилась клиника рецидива кровотечения, которая проявилась рвотой кровью, артериальной гипотензией до 90/60 мм рт.ст. и снижением гемоглобина до 57 г/л. Больной переведен в реанимационное отделение. При контрольной ЭГДС выявлены признаки состоявшегося рецидивного кровотечения. Проведен консилиум: учитывая тяжесть состояния больного, неэффективность консервативной терапии и клинико-лабораторные данные рецидива желудочного кровотечения, подтвержденного при ЭГДС, принято решение выполнить больному ангиографию с возможностью механической эмболизацией «питающего» сосуда.
19.04.2017. в условиях рентгеноперационной под местной анестезией 0,5% раствора новокаина (20,0) проведена пункция правой общей бедренной артерии по Сельдингеру, установлен интродьюсер 5 F. Катетеры С2, SIM-2 размером 5 F установлены в верхней брыжеечной артерии, чревном стволе, селезеночной и левой желудочной артерии, проведены серии снимков. При селективной ангиографии левой желудочной артерии визуализируются зоны неравномерно повышенного накопления контрастного препарата с зонами патологической неоваскуляризации (рис. 2). Рис. 2. Селективная ангиография левой желудочной артерии. Коаксиально установлен микрокатетер, визуализируются зоны неравномерно-повышенного накопления контрастного препарата, зоны патологической неоваскуляризации. Коаксиально в ветви левой желудочной и желудочных ветвей от селезеночной артерии установлен микрокатетер Progreat (Terumo) размером 2.8 Fr — 130 см. Выполнена механическая эмболизация их микросферами PVA-500 (COOK) 500—710 мкм — 2 мл, две отделяемые микроспирали Azur 18 Detachable 6 мм &s; 20 см и 4 мм &s; 15 см с использованием устройства Azur detachment controller (1) до окклюзии (рис. 3). Рис. 3. Контрольная ангиография: окклюзия левой желудочной артерии. Визуализируются установленные микроспирали. Контрольный снимок — окклюзия питающих ветвей (рис. 4). Рис. 4. Целиакография (контроль после эмболизации): окклюзия левой желудочной артерии. Катетеры удалены. Интродьюсер удален. Гемостаз мануальной компрессией, адекватный.
Через 3 сут после эмболизации афферентных сосудов выполнена контрольная ЭГДС: признаков рецидива кровотечения и зон ишемии не выявлено (рис. 5, а, Рис. 5. ЭГДС (контроль) после эмболизации левой желудочной артерии. В антральном отделе желудка видны очаги некротизированной опухолевой ткани (а); на фоне некроза опухоли виден тромбированный сосуд (б). б).
На фоне лечения состояние больного стабилизировалось, анемия скорригирована, уровень гемоглобина составил 102 г/л. Проведен онкологический консилиум: учитывая отсутствие отдаленного метастазирования, рецидивирующее желудочное кровотечение, низкий функциональный статус, рекомендовано проведение коррекции иммунологического статуса и трофологических нарушений (индекс массы тела 23,5 кг/м2), планового оперативного лечения в объеме гастрэктомии с лимфаденэктомией. Химиолучевое лечение в неоадъювантном режиме не показано.
10 мая 2017 г. больной поступил в плановом порядке в отделение абдоминальной онкологии. Индекс массы тела при поступлении 24,9 кг/м2 (прибавка в массе тела составила 4 кг).
11 мая 2017 г. выполнено плановое оперативное лечение: лапаротомия, гастрэктомия, лимфодиссекция в объеме D-2. Протокол операции. Под эндотрахеальным наркозом проведена верхнесрединная лапаротомия, в брюшной полости выпота нет, при ревизии выявлена опухоль антрального отдела желудка до 7 см в диаметре, располагающаяся по передней стенке с переходом на малую кривизну. Имеются увеличенные парагастральные лимфоузлы. Печень обычных размеров, поверхность гладкая, метастатического поражения не выявлено. Брюшина гладкая. Параортальные лимфоузлы не увеличены. Выполнена гастрэктомия с удалением малого и большого сальников с лигированием левой и правой желудочных артерий, левой и правой желудочно-сальниковых артерий и лимфодиссекцией в объеме D-2. Сформированы эзофагоеюноанастомоз на выключенной по Ру тощей кишке циркулярным сшивающим аппаратом диаметром 25 мм; однорядный тонко-тонкокишечный анастомоз «конец в бок» ПДС 3−0. В тонкую кишку за зону межкишечного анастомоза установлен зонд для питания. Гемостаз по ходу операции, объем кровопотери 200 мл. Страховой дренаж установлен справа к зоне анастомоза и выведен через контрапертуру в правом подреберье. Счет материала совпал. Выполнен послойный шов раны, наложена асептическая повязка.
Интраоперационно больному была выполнена гастроскопия с целью визуального осмотра слизистой малой кривизны желудка и зоны опухолевого поражения (рис. 6, а, Рис. 6. Интраоперационная гастроскопия. В просвет желудка вдаются ранее установленные микроспирали (а); видна некротизированная ткань стенки антрального отдела желудка (б). б).
После операции исследован макропрепарат: в основном стволе левой желудочной артерии обнаружены микроспирали, полностью обтурирующие просвет сосуда (рис. 7, а, Рис. 7. Макропрепарат. В просвете левой желудочной артерии визуализируются микроспирали (синие стрелки): а — стенка желудка на разрезе; б — сосуд в разрезе. б).
Послеоперационный период протекал без осложнений. В отделении проводилась инфузионно-корригирующая, антибактериальная, противовоспалительная, антикоагулянтная, симптоматическая терапия, больной получал энтеральное питание. На фоне терапии состояние больного с положительной динамикой. Страховой дренаж после ультразвукового исследования и контроля уровня амилазы удален на 3-и сутки, назоинтестинальный зонд после контрольного рентгенологического исследования удален на 4-е сутки. Послеоперационная рана зажила первичным натяжением.
Гистологическое заключение по макропрепарату. Умеренно-дифференцированная аденокарцинома антрального отдела желудка, G2, с очаговой периневральной инвазией, наличием опухолевых эмболов в просвете сосудистых щелей. Опухоль прорастает всю стенку желудка, очагово инфильтрирует сальник на глубину 0,3 см, pT4а, pN3а, стадия IIIС. Лимфатические узлы: 1-я группа (6 штук), позитивные — 1; 3а группа (5 штук), позитивные — 2; 3 В группа (10 штук.), позитивные — 2; 5-я группа (2 штуки), позитивные — 1; 4sа группа (2 штуки), позитивные — 0; 4d группа (1 штука), позитивные — 0; 6 группа (9 штук), позитивные — 7; 8а группа (3 штуки), позитивные — 0. Соотношение позитивных лимфоузлов к общему количеству — 13/38. В краях резекции пищевода и антрального отдела желудка опухолевого роста не обнаружено, R0.
19 мая 2017 г. онкологический консилиум, учитывая стадию заболевания (pT4а pN3а М0, стадия IIIС), распространенность опухолевого процесса, рекомендовал больному проведение восьми курсов адъювантной химиотерапии по схеме XELOX, наблюдение онколога по месту жительства.
При обследовании через 5 мес признаков прогрессирования онкологического заболевания не выявлено, проходит пятый курс полихимиотерапии.
Проблема лечения рака желудка, осложненного кровотечением, по-прежнему продолжает оставаться весьма актуальной. Доля больных с таким осложнением достигает 41,5% [2, 3].
В структуре неязвенных желудочных кровотечений рак желудка составляет 10—55% [3]. Несмотря на совершенствование техники хирургических вмешательств и методик интенсивной терапии, послеоперационная летальность у пациентов с кровоточащим раком желудка достигает 50—60% [1, 3].
В настоящее время пока нет оснований признать результаты хирургического лечения этого контингента больных удовлетворительными. Об этом говорят достаточно высокие цифры послеоперационной летальности (15—20%), низкие показатели операбельности и резектабельности больных, составляющие в среднем 45—62,1% [3, 4, 13]. Отмечается большое количество послеоперационных осложнений, а показатели 5-летней выживаемости незначительно превышают 20% от числа оперированных больных [6, 9, 12]. В значительной степени это связано с нарушениями гомеостаза, водно-электролитного обмена, что определяет тяжесть состояния этих больных и их неоперабельность [2, 7, 13].
В настоящее время вопрос о выборе лечебной тактики и методов оперативного лечения у больных кровоточащим раком желудка остается дискутабельным [4, 5, 16]. Используемые эндоскопические методы гемостаза не всегда оказываются окончательными методами остановки кровотечения из распадающейся опухоли.
Альтернативой хирургическому лечению является селективная или суперселективная эмболизация афферентного сосуда. Обзор современной литературы свидетельствует о том, что ангиографический доступ с артериальной эмболизацией для лечения осложненных кровотечением опухолей желудочно-кишечного тракта может быть использован при неэффективности или невозможности применения альтернативных методов лечения.
В нашем клиническом случае у пожилого больного с сопутствующими хроническими заболеваниями (сердечно-сосудистая недостаточность, сахарный диабет 2-го типа, доброкачественная гиперплазия предстательной железы 2-й стадии, тромбоз вен нижних конечностей и т. д.) на фоне значимых рецидивов желудочного кровотечения из распадающейся опухоли антрального отдела желудка, прогрессирующей вследствие этого анемии, после эндоскопического гемостаза (с кратковременным эффектом) в процессе дообследования и подготовки к оперативному лечению выполнена селективная ангиография с эмболизацией афферентного сосуда. Эта современная рентгенэндоваскулярная операция позволила стабилизировать общее состояние пациента, дообследовать, подготовить, выполнить радикальную плановую операцию и перейти к следующему этапу лечения —
