Рак желудка комбинированная
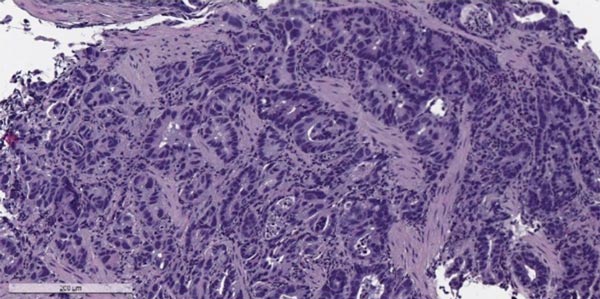
Рак желудка – злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения – хирургический, удаление всего желудка или его пораженной части.
Причины рака желудка
Точные причины рака желудка неизвестны. В слизистой оболочке органа возникают мутации ДНК, и получаются «неправильные» клетки, которые могут приобрести способность к неконтролируемому росту. Почему это происходит — не совсем понятно. Зато хорошо изучены факторы риска — условия, которые повышают риск рака желудка.
Наследственность и рак желудка
Некоторые люди носят в себе «бомбу замедленного действия», спрятанную в генах. Иногда даже не одну. Это подтверждается некоторыми фактами:
- Если у близкого родственника (родители, братья, сестры, дети) человека диагностирован рак желудка, его риски повышены примерно на 20%.
- Мужчины болеют чаще, чем женщины. Сложно сказать, с чем конкретно это связано, но можно предположить, что замешана разница между мужскими и женскими генами.
- Японцы, которые мигрировали в США, болеют раком желудка реже соотечественников, но чаще, чем «коренные» американцы. Это говорит о том, что дело не только в характере питания, но и в наследственности. Главный подозреваемый — ген под названием RNF43.
- Карцинома — самый распространенный тип рака желудка — чаще встречается у людей с группой крови A (II), которую они, конечно же, получили вместе с генами.
- Риски повышены при некоторых наследственных заболеваниях: злокачественной анемии (в 3-6 раз), гипогаммаглобулинемии, неполипозном раке толстой кишки.
- Заболеваемость раком желудка повышается после 70 лет: считается, что это происходит из-за того, что с возрастом в клетках тела накапливаются нежелательные мутации.
Рак желудка и характер питания
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Рак желудка и вредные привычки
Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
Хеликобактер пилори (H. Pylori) и рак желудка
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
Другие факторы риска
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз – заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
- Кишечный. Как следует из названия, в окружении опухоли имеется кишечная метаплазия, то есть слизистая оболочка желудка становится похожа на слизистую кишечника. Этот тип рака чаще встречается у пожилых людей, отличается более благоприятным прогнозом. Это типично «японский» тип рака.
- Диффузный. Опухолевые клетки расползаются по стенке желудка, они окружены нормальной слизистой оболочкой.
- Смешанный.

Аденокарцинома желудка
Стадии рака желудка
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx – первичную опухоль невозможно оценить;
- T0 – первичная опухоль не обнаруживается;
- T1 – тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки (“рак на месте”);
- T2 – опухоль проросла в мышечный слой стенки органа;
- T3 – рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 – опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx – невозможно оценить метастазы в лимфатических узлах;
- N0 – метастазы в регионарных лимфоузлах не обнаружены;
- N1 – поражены 1-2 лимфоузла;
- N2 – опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 – метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 – отдаленные метастазы не обнаружены;
- M1 – обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 – стадия Ia; T1N1M0, T2N0M0 – стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 – стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 – стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 – стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 – стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 – стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
На ранних стадиях рак желудка либо не имеет симптомов вообще, либо маскируется под другие заболевания: гастрит, обострение язвенной болезни. Ухудшение аппетита и боли под ложечкой редко заставляют людей сразу же подозревать онкозаболевание и бежать в больницу. Обычно ограничиваются диетой и приемом разрекламированных таблеток «от желудка». Если человек уже страдает язвенной болезнью, он может воспринять первые признаки рака желудка как очередное обострение язвы. И уже позже, когда диагностировано онкологическое заболевание, больной вспоминает, что проявления были «не такими, как всегда».
Существует так называемый «синдром малых признаков» — его сформулировал один из основоположников советской онкологии, Александр Иванович Савицкий. Если беспокоят похожие симптомы — это повод сходить к врачу и провериться:
- Необъяснимая слабость и повышенная утомляемость.
- Плохой аппетит.
- Снижение работоспособности.
- Потеря веса.
- «Желудочный дискомфорт»: неприятные ощущения, из-за которых даже любимая еда больше не радует.
В дальнейшем нарастают более яркие, «кричащие» признаки. Они зависят от того, в какой части органа находится опухоль:
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Со временем в опухоли начинаются процессы изъязвления и распада, развивается желудочное кровотечение. Проявляется оно в виде черного дегтеобразного стула, рвоты, которая выглядит как «кофейная гуща» или содержит примеси алой крови. Если человек теряет много крови, он становится бледным, возникает слабость, головокружение. У некоторых людей рак диагностируется, когда их приводят в клинику в таком состоянии на машине «Скорой помощи».
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В клиниках «Евроонко» существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.
Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака – Япония, во многом за счет характера питания.
В Европейской онкологической клинике применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
Цены на лечение рака желудка на 1-4 стадиях
- Консультация онколога — 5100 руб.
- Лечение рака желудка — от 60000 руб.
- Проведение внутриплевральной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 21900 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 17200 руб.
Источник

Книга “Комбинированные операции при раке желудка”
Рак желудка является одним из самых распространенных онкологических заболеваний. В России рак желудка занимает второе место в структуре заболеваемости населения злокачественными новообразованиями.
За последнее десятилетие двадцатого века заболеваемость раком желудка снизилась в России с 44,5 до 33,6 среди мужчин и с 19,6 до 14,8 на 100 ООО населения среди женщин. Однако, несмотря на систематическое многолетнее снижение заболеваемости раком желудка и смертности от него, эта патология остается одной из важнейших медицинских и социально-экономических проблем. Ее важность ярко иллюстрируют те же статистические показатели. Например, в 1999 году в России заболело раком желудка 48,8 тысяч человек, умерло от рака желудка – 45,1 тысяч человек, летальность на первом году после установления диагноза составила 56,9 % (Аксель Е.М., Давыдов М.И., Ушакова Т.Н., 2001).
Неоспоримый факт снижения заболеваемости раком желудка является малым утешением для российских онкохирургов и потому, что все крупные онкологические центры отмечают увеличение как удельного веса, так и общего количества обращений больных в запущенных, распространенных стадиях болезни. В том же 1999 году в России распределение вновь выявленных больных по стадиям было следующим: I—II стадии болезни – 18,1%, III – 31,3%, IV – 42,6%; стадия не установлена у 8,0% больных (Аксель Е.М., Давыдов М.И., Ушакова Т.И., 2001). Кроме того, наблюдается интенсивный рост числа низкодифференцированных форм рака, которые встречаются чуть ли не у половины заболевших.
Вместе с повсеместным уменьшением показателей заболеваемости раком желудка, в течение двух последних десятилетий отмечается увеличение частоты аденокарциномы кардиального отдела желудка и кардиоэзофагеального перехода в странах Западной Европы и в США. Частота этого заболевания увеличивается так интенсивно, как ни одна другая форма опухоли.
На сегодняшний день поиск новых подходов, позволяющих надеяться на улучшение отдаленных результатов лечения, сохраняет свою актуальность. Выбор оптимального варианта лечения больных раком желудка до настоящего времени остается одной из наиболее сложных и дискуссионных проблем у представителей различных онкологических и хирургических школ и направлений.
Наиболее ярким образцом различий подходов в лечении рака желудка традиционно принято считать западную и японскую школы (хотя в последнее время отмечается стойкое схождение позиций этих школ). Примечательны часто противоречивые результаты исследований, проводимых с применением, казалось, одинаковых схем диагностики и лечения.
Неоспорим, впрочем, только тот факт, что до настоящего времени основным и наиболее эффективным компонентом лечения рака желудка остается хирургический.
Хирургическое лечение рака желудка имеет более чем вековую историю. Общепризнано, что приоритет в выполнении дистальной резекции желудка принадлежит Реап (Франция, 1879), Rydygier (Польша, 1880), Billroth (Австрия, 1881). Именно Теодору Бильроту удалось выполнить первую успешную, в плане непосредственных результатов (больная умерла через четыре месяца от рецидива заболевания), резекцию желудка. Первую попытку гастрэктомии сделал Connor (США, 1884); операция закончилась смертельным исходом. Первую успешную гастрэктомию выполнил Schlater (Австрия, 1897).
Особый вклад в развитие хирургии рака желудка сделан отечественными хирургическими школами. Значительную лепту в разработку хирургических подходов и методик внесли почти все видные хирурги прошлого века. Примечательно, что первую резекцию желудка в России выполнил Китаевский (С.-Петербург) в 1881 году, то есть спустя лишь 5 месяцев после Бильрота.
Хирургическое лечение рака желудка не может осуществляться без планомерного использования по соответствующим показаниям различных видов комбинированных гастрэктомий и резекций, что доказано опытом многих отечественных и зарубежных хирургов. При комбинированных операциях очень важно уделять особое внимание сбалансированному подходу в решении вопросов радикализма, безопасности и восстановления функции организма. Даже если резекция при раке желудка является паллиативной, она в любом случае ликвидирует симптомы заболевания и увеличивает срок жизни больного.
Быстрое распространение раковой опухоли желудка в глубину приводит к тому, что не менее чем у одной трети больных, госпитализированных для хирургического лечения, отмечено прорастание опухоли в соседние органы (Мартынюк В.В., Кузнецов А.И., 1985; Mabogunje О.A., Lawrie Y.H., 1985; Denecke Н., 1989). Частота комбинированных операций среди радикальных вмешательств при раке желудка в среднем составляет 12,8-31,0% (Ванцян Э.Н., 1978; Давыдов М.И., Саакян А.М., 1992; Кочегарова А.А. и соавт., 1989; Кухаренко З.М., Баймухамедов А.А., 1994; Аманов С.А. и соавт., 1996).
Первые попытки выполнения комбинированных операций при раке желудка относятся к концу XIX века. В 1890 году Schede впервые успешно осуществил комбинированную операцию с одномоментной резекцией поперечно-ободочной кишки. В отечественной хирургии рака желудка первые комбинированные гастрэктомии выполнил С.Ф. Дерюжинский.
Первыми принципиальными сторонниками выполнения комбинированных операций являлись R.R. Graham (1943), Н. Lefevre (1946), P. Allison и S. Borrie (1949). Учитывая пути лимфооттока от проксимального отдела желудка, они указывали на необходимость спленэктомии и резекции хвоста и тела поджелудочной железы во всех случаях рака кардиального отдела желудка. Таким образом, в середине прошлого века наметилась тенденция к выполнению комбинированных операций по принципиальным соображениям онкологического радикализма, когда вмешательство на желудке при далеко зашедшем раке дополняется удалением зоны вероятного наличия метастазов, включая резекцию смежных органов.
По мнению ряда авторов (Мельников А.В., 1957; Саакян А.М., Давыдов М.И., 1992; Karaesonyi S. et al., 1990; Korenaga D. et al., 1990), комбинированные операции в сочетании с расширенной лимфодиссекцией увеличивают показатели пятилетней выживаемости у больных раком желудка. При этом прогноз заболевания в большей степени определяет полноценно выполненная расширенная лимфодиссекция (Харитонов Л.Г., 1983; Сукач С.Е., 1992; Takahashi Т., 1985; Jirkova A. et al., 1989).
Одним из вариантов комбинированной резекции при раке желудка является левая верхняя абдоминальная эвисцерация, предложенная и внедренная в клиническую практику японскими хирургами в 1980 году (Nishi М., 1993). По мнению этих авторов, обычное хирургическое лечение распространенного диффузного рака желудка, как правило, сопровождается неблагоприятным прогнозом. Это связано с повышенной метастатической активностью опухоли и ее частым имплантационным распространением. При этом иногда, по обстоятельствам, резекции или удалению подвергаются диафрагма, левая доля печени, левый надпочечник и левая почка.
Главным образом левосторонняя верхняя абдоминальная эвисцерация показана больным раком проксимального отдела или средней трети желудка в тех случаях, когда имеется: 1) опухолевая инфильтрация серозного покрова желудка на достаточно большом участке, особенно по большой кривизне или по задней стенке желудка; 2) распространение опухоли по лимфатическим путям на окружающие желудок ткани; 3) прямое врастание рака желудка или опухолевого конгломерата из лимфатических узлов в окружающие желудок ткани и органы, начальная, ограниченная по распространенности диссеминация по брюшине, в том числе малого и/или большого сальников, мезоколон, особенно когда диссеминация ограничена сальниковой сумкой. М. Nishi и его коллеги (1985, 1993) применили данную операцию у 103 из 6 236 больных раком желудка, оперированных с 1960 по 1989 год. Частота послеоперационных осложнений составила 57%. Послеоперационная летальность на протяжении 1 месяца после операции была равна 6,3%, которая не представляется столь высокой при сравнении с показателями летальности после стандартных операций. Однако пятилетняя выживаемость оказалась не так высока, как ожидалось, и составила всего лишь 8%.
Несмотря на это, операция даже тем больным, которые умерли, значительно продлила жизнь и многих пациентов освободила от болевых ощущений.
В зависимости от того, по каким причинам были произведены комбинированные операции, Б.Е. Петерсон (1976) разделял их на следующие группы:
1) вынужденные, по онкологическим показаниям;
2) по «принудительно-онкологическим соображениям», когда макро-морфологических данных для такого расширения операции нет;
3) по «техническим причинам».
Наиболее неблагоприятными в прогностическом отношении являются наблюдения, когда опухоль желудка прорастает в соседние органы. Прогноз значительно лучше у тех больных, у которых имеется воспалительное спаяние желудка с соседними органами и которым одновременно выполнялась комбинированная операция с расширенной лимфодиссекцией.
К.В. Даниельбек (1974) сообщил, что среди больных раком желудка, которым были выполнены комбинированные операции вследствие ошибочной оценки границ опухолевого поражения или по техническим причинам, пять лет прожили 23,6%.
Результаты комбинированных операций при истинном прорастании опухоли в окружающие органы по их данным были малоудовлетворительными. Из 27 больных, у которых имелось истинное прорастание опухоли в соседние органы, 5-летний срок прожил только один.
Большинство хирургов выполняет комбинированные операции по онкологическим показаниям, то есть либо при прорастании опухоли желудка в соседние органы и ткани, либо вследствие обширного метастатического поражения регионарных лимфатических узлов. Однако возможность интраоперационного подтверждения истинного врастания опухоли желудка в соседний орган при срочном гистологическом исследовании весьма сомнительна, и это подразумевает необходимость его удаления для исследования. Достоверное определение истинного врастания рака желудка в соседний орган возможно лишь при гистологическом исследовании методом серийных срезов.
По данным МНИОИ им. Герцена, из 302 комбинированных операций при раке желудка в 73,2% наблюдений вмешательства выполнены при местно-распространенном процессе. При этом плановое гистологическое исследование операционных препаратов дало заключение об истинном прорастании рака желудка в окружающие органы и ткани только в 47,2% случаев. Требует внимания тот факт, что у 19,9% больных после комбинированных вмешательств была выявлена I—II стадии процесса. Таким образом, более чем в 50% наблюдений не представляется возможность дифференцировать истинное опухолевое прорастание от паратуморального воспаления с последующим спаянием с окружающими тканями. Отказ от выполнения комбинированного хирургического вмешательства в подобных ситуациях мог бы лишить пациентов шанса на выздоровление.
При выполнении комбинированных резекций течение раннего послеоперационного периода складывается из особенностей, присущих вмешательствам на каждом из органов. Более того, послеоперационные осложнения, присущие манипуляциям на каждом из органов, могут закономерно вызвать развитие различных осложнений со стороны других составляющих комбинированных вмешательств (вторичная несостоятельность пищеводных анастомозов при развитии острого послеоперационного панкреатита и т.д.).
В современной литературе четко прослеживаются определенные тенденции, характеризующие новые направления в подходах к диагностике и хирургическому лечению рака желудка. Отмечается рост числа больных, которым операции выполняются с расширенной лимфодиссекцией. Увеличивается удельный вес больных, которым производят комбинированные гастрэктомии. Можно говорить о более агрессивном подходе к хирургическому лечению больных раком желудка. Большая группа авторов свидетельствует в пользу расширенных комбинированных операций по поводу рака желудка, не отмечая при этом сколь-либо существенного увеличения частоты послеоперационных осложнений и летальности.
Мы полагаем, что решение проблем расширенных и комбинированных оперативных вмешательств при раке желудка связано с накоплением достаточного хирургического опыта, индивидуализацией в связи с этим тактических и патогенетических подходов к их выполнению. Актуальными остаются вопросы разработки технически простых и надежных способов профилактики ранних послеоперационных осложнений при хирургических операциях по поводу рака желудка и широкого их внедрения в клиническую практику. Широкое внедрение комбинированных вмешательств при раке желудка невозможно без разработки технических аспектов повышения надежности таких соустий, а также формирования принципов патогенетического подхода к выбору конкретных методик их наложения.
Источник
