Рак желудка яицкий
Основные проблемы лечения рака желудка
Основную проблему лечения рака желудка в настоящее время можно сформулировать так: общая низкая эффективность, несмотря на все доступные достижения медицинской науки.
Когда читаешь публикации о разных методах, применяемых для лечения этого заболевания в настоящее время, удивляешься ярко выраженному несоответствию между эффективностью каждой предлагаемой методики и общими цифрами пятилетней выживаемости, которые остаются достаточно низкими. Думаю, наиболее достоверно отражают состояние проблемы исследования, проведенные на основе анализа большого количества историй болезни в странах, где медицина имеет возможность применить для всех пациентов максимально эффективные стандартные методики. Это США, страны Европы. Крупные исследования, построенные на анализах результатов лечения 1000 и более пациентов, говорят о том, что пятилетняя выживаемость при раке желудка не превышает 25%. К нашей чести, примерно такие же результаты лечения мы наблюдаем и в России, несмотря на все трудности отечественной медицины. На фоне этого резко выделяются исследования японских авторов, где цифры пятилетней выживаемости значительно выше и превышают 60%. Главная причина этого: скрининг и ранняя диагностика рака желудка в Японии.
Что же делать нам, докторам, профессионально занимающимся лечением рака желудка в России? Очевидно, что в сложившейся ситуации помимо усилий, направленных на раннее выявление заболевания, мы должны искать пути и возможности справляться и с гораздо более часто встречающимися другими, поздними стадиями заболевания.
Значение хирургического лечения рака желудка
Конечно, возможности лечения рака желудка не исчерпывается операцией. Однако, хирургический метод в лечении рака данной локализации в настоящее время является ключевым. Причин этому две: только он дает возможность радикального лечения опухоли, и только он дает возможность достоверного стадирования. Но для того, чтобы реализовать эти возможности, необходимо изменять негласно существующий подход к операциям.
Что я имею в виду? Лимфодиссекцию как элемент повышения радикальности операции и единственно достоверного инструмента стадирования рака желудка по критерию N. Отличия в радикальности выражаются в цифрах, в зависимости от контингента больных, разнородности материала, по данным разных авторов, от 0 до 20% (если не брать излишне оптимистичные работы). Да, число операбельных больных у которых одновременно присутствуют метастазы как в лимфатических узлах 1, так и в лимфатических узлах 2 порядка, и отсутствуют в лимфатических узлах 3 порядка, при отсутствии гематогенных метастазов, применительно ко всем остальным пациентам, невелико (предположительно около 10% от всех радикально оперируемых пациентов). Но они есть. Зачем нужно достоверное стадирование опухоли? Чтобы обеспечить документированное подтверждение радикальности вмешательства (хирург получает информацию об адекватности объема лимфодиссекции), определить показания и обоснованный выбор дальнейшего лечения, обеспечить выбор адекватного, направленного на раннее выявление рецидива и своевременное применение других методов лечения режима наблюдения за пациентом после операции. Кроме того, если врач занимается разработкой собственных методов лечения и диагностики или совершенствованием уже существующих, только достоверное стадирование опухоли позволяет оценить чувствительность и специфичность методов диагностики и подтвердить эффективность примененных методов лечения.
Коллеги! Я предлагаю Вам вспомнить, кто и где видел в истории болезни или в выписке результаты гистологического исследования 16 и более лимфатических узлов, удаленных в ходе лимфодиссекции и позволяющих с минимальной точностью стадировать рак желудка по критерию pN? Редко встречается? В то же время, ретроспективный анализ историй болезни пациентов нашей клиники (клиника факультетской хирургии СПбГМУ им. акад. И.П.Павлова) с 1993 по 2006 год выявил, что метастазы в лимфатические узлы присутсвовали у 82,5% больных раком желудка.
Улучшение лимфодиссекции при раке желудка
Значение лимфодиссекции в хирургии рака желудка хорошо обосновано в работах и докладах многих авторов, как отечественных, так и зарубежных. Конечно, лимфодиссекция, хоть и в несколько другом виде, описана и выполняется онкологами и хирургами в ходе радикальных операций по поводу рака желудка уже давно, задолго до того, как вопрос был детально проработан и обоснован японскими авторами.
Существующие стандарты хирургического лечения рака желудка основаны на японских работах, в частности втором европейском издании классификации рака желудка JGCA 1998 года (jcgc-2e.pdf). Не останавливаясь на известных Вам общих вопросах лимфодиссекции при раке желудка, хочется подчеркнуть заложенное в них трудноразрешимое противоречие:
- С одной стороны, сложность строения лимфатической системы желудка и возможность так называемого skip-метастазирования, когда метастазы отсутствуют в лимфатических узлах ближайших к опухоли, но выявляются в лимфатических узлах второй и даже третьей линии, заставляют хирурга расширять объем лимфодиссекции для обеспечения радикальности операции.
- С другой стороны, при этом одновременно увеличивается длительность и техническая сложность операции, повышаются ее агрессивные свойства и создаются условия для увеличения частоты осложнений.
Одним из направлений моего исследования являлась отработка методики интраоперационного картирования лимфооттока, призванной оказать помощь хирургу в выполнении лимфодиссекций любого объема от D1 до D3, а также повысить точность интраоперационного и послеоперационного стадирования опухолей желудка.
В качестве картирующего вещества использовался лимфотропный краситель, который вводили в стенку желудка субсерозно над опухолью. Проанализировав полученные результаты, мы пришли к следующим основным выводам:
- Интраоперационное картирование путей лимфооттока дает возможность лучше ориентироваться хирургу при лимфодиссекции в ходе операций по поводу рака желудка.
- Выявление и исследование «сигнального» лимфатического узла, как наиболее вероятного объекта лимфогенного метастазирования, может повысить точность послеоперационного стадирования рака желудка.
- Визуализация лимфатических узлов в препарате дает возможность увеличить количество лимфатических узлов, направляемых на гистологическое исследование.
Методика разработана и опробована для всех случаев операбельного рака желудка, не только для ранних стадий.
Источник
Чем опасен рак желудка?
Рак желудка – опасное заболевание. Это обусловлено тем, что он относительно часто встречается, но при этом имеет минимум клинических проявлений до самых поздних стадий заболевания. Эффективность же его лечения при поздней диагностике резко снижается.
Среди всех онкологических заболеваний, рак желудка (по данным Давыдова М. И.,и соавт., 2000) сейчас занимает 2 место у мужчин (14,7%) и 3 – у женщин (10,8%). В целом заболеваемость по России в 2003 году составила 31,40 на 100000 населения (грубый показатель). В Санкт-Петербурге эти показатели выше, чем в России: мужчины – 42,4, женщины – 18,8. Но плохо не это, а то, что у 64,2 % больных (по данным Аксель Е. М., и соавт., 2008) диагностируется III – IV стадии болезни.
Об этом следует помнить всем: и врачам, и пациентам. Но этого мало, необходимо понимать как переломить ситуацию применительно к конкретному данному случаю, повысить шансы специалистов в тяжелой борьбе с этой проблемой.
Что нужно делать, чтобы успешно справиться с заболеванием?
Когда мы обсуждаем статистику какого-либо заболевания мы не задумываемся обычно, что стоит за сухими цифрами. Например: когда в результате сложного лечения 99% пациентов излечивается, а 1% умирает – это хорошо или плохо? Я понимаю так: со стороны 1% погибших – это плохо, какие бы аргументы мы не приводили. А при раке желудка речь идет совсем не о таком красивом соотношении. Разрушить сложившийся порядок вещей могут только совместные усилия пациента и доктора.
Задача пациента – знать кое-что о развитии рака желудка, чтобы вовремя обратиться за помощью. Задача врача – отнестись неформально, знать достаточно для того, чтобы правильно оценить степень риска и своевременно поставить диагноз.
В России не проводится тотальных скрининговых обследований с целью выявления рака желудка. Но как тогда не опоздать на прием к специалисту? Ответ прост: не стоит дожидаться явных симптомов болезни. Боли в животе, рвота сьеденной пищей, черный стул и рвота вида “кофейной гущи”, затруднение прохождения пищи по пищеводу, нарушения аппетита вплоть до отвращения к пище (простой пище, мясным блюдам), быстрая насыщаемость чаще всего появляются поздно! Обращаться к врачу уже нужно, если появились неспецифические симптомы, описанные А.И.Савицким еще в 1966 году в составе “синдрома малых признаков”:
- Немотивированные диспептические явления
- Неопределенный «желудочный дискомфорт»
- Прогрессирующая анемия
- Нарастающая физическая слабость
- Похудание
- Беспричинная психическая депрессия (утрата радости жизни, интереса к окружающему, апатия, отчужденность)
- Ухудшение работоспособности
- Нарушение сна
Ключевым моментом в использовании этих признаков является отсутствие причины для них, но, конечно, чтобы достоверно оценить это, нужно иметь медицинское образование. Поэтому, при сомнениях всегда нужно обращаться к врачу.
Еще нужно обратиться к врачу, обследоваться и постоянно наблюдаться при наличии одного из следующих заболеваний:
- Полипы желудка (в зависимости от типа – вероятность перерождения в рак составляет от 20 до 75%)
- Хронический атрофический гастрит (до 13%)
- Пернициозная анемия (до 12,5%)
- Болезнь Менетрие (5-10%)
- Язва желудка (1-2%)
К важным факторам риска следует отнести также:
- Состояние после резекции желудка
- Рак желудка у ближайших родственников.
Я надеюсь, что приведенная информация поможет понять всем как важно рано диагностировать рак желудка и покажет пути, как это можно сделать.
Источник

Одним из важных аспектов работы любого врача является проявление онкологической настороженности, так как существует ряд опухолей, который на ранних стадиях развития не дает выраженной клиники, но остается при этом достаточно распространенным в популяции явлением. Одним из таких новообразований является рак желудка, который в структуре смертности от злокачественных новообразований у мужчин стоит на втором месте, а у женщин на третьем.
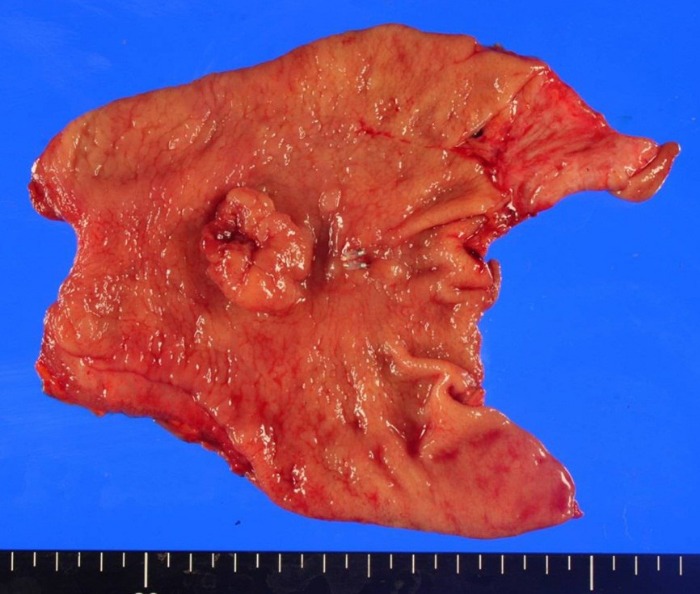
Грибовидная карцинома желудка с изъязвлением, располагающаяся в антральном отделе.
Рак желудка — злокачественная опухоль, исходящая из слизистой желудка. Слизистая оболочка представлена однослойным цилиндрическим эпителием, собственной пластинкой и мышечной, образующей складки, желудочные поля и желудочные ямки, в которые выходят выводные протоки желудочных желез. Рак желудка в 90 % случаев представлен аденокарциномой.
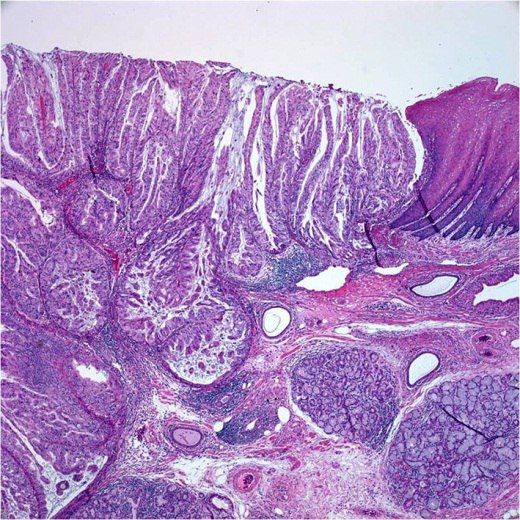
Папиллярная аденокарцинома гастроэзофагеального перехода с инфильтрацией опухоли в подслизистую оболочку.
Этиология
На данный момент нет однозначного ответа на вопрос об этиологии развития заболевания. Главенствующее значение отводится хроническому инфицированию Helicobacter pylori. Среди других причин упоминается инфицирование вирусом Эпштейна-Барр, генетические мутации, ожирение и влияние факторов среды. Среди средовых факторов наибольшее влияние имеет курение, содержащая нитраты и маринованная пища.
Поэтому большое внимание в практике врача уделяется лечению фоновых для развития рака заболеваний, таких как хронический атрофический гиперпластический гастрит, ассоциированный с Helicobacter pylori, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие (гипертрофическая гастропатия, гиперпластический гигантоскладочный гастрит), а также лечению предраковых изменений слизистой оболочки: кишечной метаплазии и дисплазии.
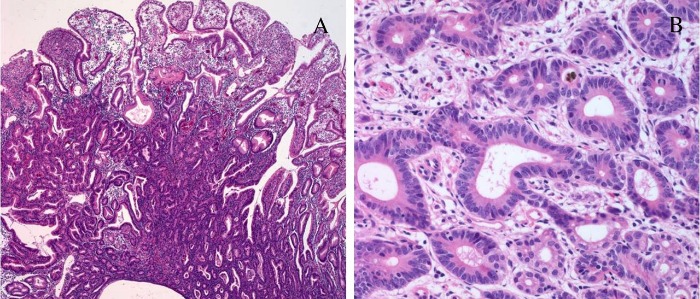
Тубулярная аденокарцинома
Патогенез
Среди теорий канцерогенеза рака желудка доминирует теория каскада Р. Соrrеа, предложенная автором еще в 1988 г. На тот момент эта модель не включала H. pylori, ее включили лишь на два года позднее. Сведений, достоверно подтверждающих синтез или секрецию бактерией мутагенных или канцерогенных субстанций нет. Поэтому согласно теории хроническая персистенция H. pylori вызывает только нарушение клеточного обновления слизистой оболочки желудка, заключающееся в ускоренном перемещении клеток из генеративной зоны без полноценной дифференциации в зоны расположения зрелых специализированных эпителиоцитов. Это происходит вследствие продукции цитокинов и кислородных метаболитов клетками воспалительного инфильтрата. Развивается неспособность желудочных желез к полноценной функции и как следствие атрофия, метаплазия, дисплазия и карцинома.
Среди причин, вызывающих диффузный рак, отмечаются генетические мутации в генах CDH1 и CTNNA1. Мутация, произошедшая в гене TP53 вызывает синдром Ли-Фраумене, в гене APC — семейный аденоматозный полипоз.
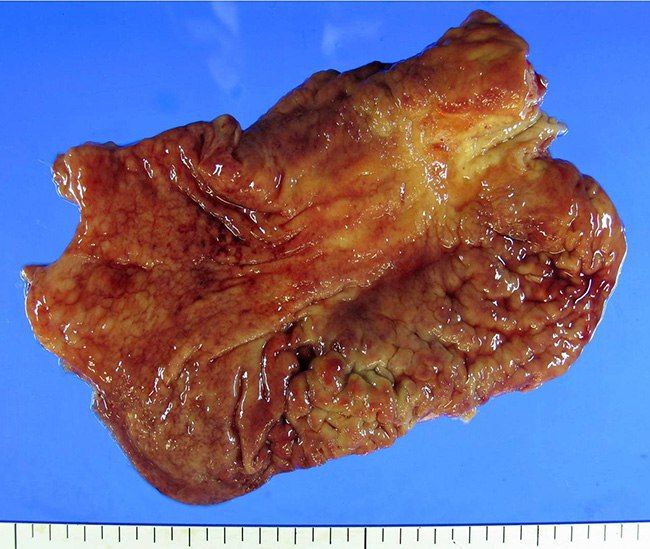
Диффузно-инфильтративный рак желудка (linitis plastica)
Клиническая картина и симптоматика
Опухоль на ранних стадиях не имеет патогномоничных симптомов. С развитием заболевания присоединяются следующие симптомы:
- Местные могут быть представлены болью в эпигастральной области. С течением заболевания характер изменяется на опоясывающий при прорастании в поджелудочную железу, стенокардитический при прорастании в диафрагму. При расположении в области кардии возникает дисфагия, со временем присоединяется чувство тяжести за грудиной, тошнота, рвота. При развитии опухоли в пилорическом отделе возникает нарушение эвакуации пищи и, как следствие, тяжесть после приема пищи в эпигастрии, рвота съеденной накануне пищей, отрыжка тухлым, плеск жидкости, схваткообразными болями вследствие усиления перистальтики желудка. При прорастании новообразования в поперечную ободочную кишку возникает вздутие живота, урчание и задержка стула.
- К общим проявлениям относятся: потеря аппетита, отвращение к пище или отсутствие чувства насыщения, снижение веса, нарастающая слабость, повышенная утомляемость. Данный симптомокомплекс А.И. Савицким объединен в «синдром малых признаков».
- Опухоль, осложнившаяся кровотечением, проявляется слабостью, головокружением, сердцебиением, утомляемостью, обморочными состояниями, рвотой неизмененной кровью, или, “кофейной гущей”, меленой (дегтеобразным калом). При возникновении перфорации возникают “кинжальные” боли, усиливающиеся при движении, возникает выраженная слабость, холодный пот, иногда потеря сознания. Лихорадка с интоксикационным синдромом возникают при инфицировании опухоли.
- При появлении метастазов в печени, сдавлении внепеченочных желчных протоков, возникает желтуха, присоединяется кожный зуд. Карциноматоз брюшины или сдавление воротной вены проявляется асцитом, непроходимостью. При значительном росте метастаза Шницлера в параректальной клетчатке возникает нарушение дефекации. Нарушение функций яичников возникает при двустороннем поражении яичников (Крукенберговский рак). Пальпаторно определяются метастазы Айриша в подмышечные лимфатические узлы, Вирхова в левый надключичный узел и метастаз сестры Марии Джозеф в пупок по ходу круглой связки печени.
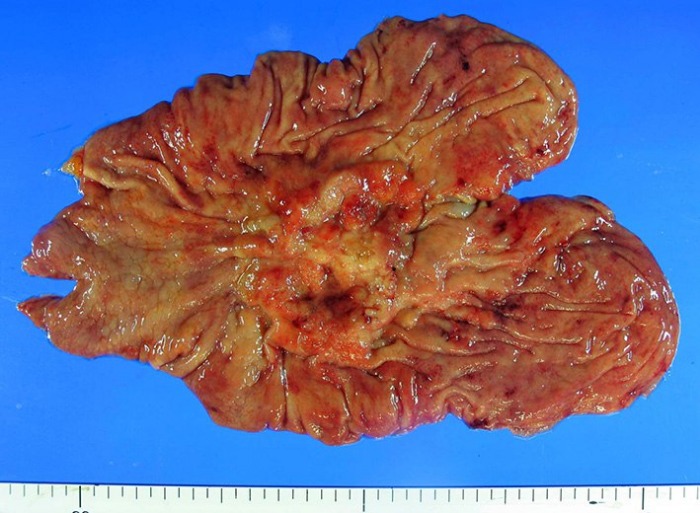
Инфильтративно-язвенный тип рака желудка, расположенный в теле желудка по малой кривизне.
Лечение
Выполняется с использованием хирургических технологий (в том числе эндоскопических), комбинированной химиотерапии, и лучевых методов.
Эндоскопически оперируется:
- ранний рак у пациентов с высоким риском хирургического вмешательства;
- карцинома, располагающаяся в пределах слизистой оболочки;
- размер опухоли не превышающий 2 см и без изъязвления;
- новообразование с отсутствием метастатического поражения регионарных и отдаленных лимфатических узлов;
- рак с отсутствием лимфоваскулярной инвазии.
Существует два варианта эндоскопических операций: резекция слизистой и резекция слизистой с диссекцией подслизистого слоя. Если после планового гистологического исследования удаленной части выявляется инвазия опухолевых клеток в подслизистый слой, низкодифференцированная форма рака или лимфовенозная инвазия, пациент подлежит хирургическому лечению.
Если у пациента обнаруживается подслизистая инвазия, большая протяженность, низкодифференцированные формы, изъязвленные опухоли, то проводится субтотальная резекция желудка или гастрэктомия с лимфаденэктомией.
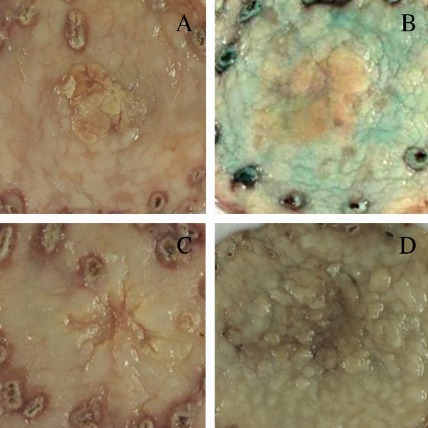
Ранний рак желудка. А: тип I (возвышенный). В: тип IIа (приподнятый). С: IIc (углубленный). D: IIb+IIc (плоский, углубленный)
Планирование и реализация хирургического лечения включает несколько этапов: выбор оперативного доступа, выбор объема операции на органе, лимфодиссекция, выбор способа реконструкции:
Выбор оперативного доступа зависит от уровня распространения опухоли. Если нет вовлечения кардиоэзофагеального перехода и пищевода, то доступ срединный лапаратомный. При ограниченном поражении дистального отдела пищевода и кардии — тораколапаратомный доступ слева либо широкая диафрагмотомия из лапоротомного доступа. При тотальном поражении желудка с переходом на пищевод или раке тела с проксимальным распространением на пищевод — абдоминомедиастинальный (в ряде случаев, при высоком пересечении пищевода, с целью безопасного формирования пищеводно-кишечного соустья, возможно применение торакотомии слева по VI межреберью).
Выбор объема операции включает в себя такие варианты как гастрэктомию, субтотальную дистальную и субтотальную проксимальную резекции желудка:
Радикальная операция включает единовременное удаление пораженного участка желудка с двумя сальниками, клетчаткой, лимфатическими узлами регионарных зон; орган пересекается на расстоянии не менее 5 см от видимого края опухоли с ограниченным типом роста и не менее 6–7 см при раке язвенно-инфильтративного и диффузного типов. Подтверждение полного иссечения опухоли происходит путем проведения срочного гистологического исследования по линии пересечения.
- Дистальная субтотальная резекция желудка проводится при раке антрального отдела желудка без очагов тяжелой дисплазии и рака in situ в проксимальной части желудка либо у больных с низкими функциональными резервами при распространении экзофитной или опухолью со смешанной формой роста на нижнюю треть тела желудка. Левые паракардиальные лимфатические узлы и узлы в воротах селезенки не удаляются, так как поражаются при этом типе рака редко.
- Проксимальная субтотальная резекция желудка показана при раке кардиоэзофагеального перехода, при небольших опухолях верхней трети желудка экзофитной или смешанной формы роста.
- Гастрэктомия с удалением всех регионарных лимфоузлов проводится во всех остальных случаях. При резектабельном раке желудка типа linitis plastica (диффузный рак), недифференцированных формах рака, синдроме наследственного рака желудка диффузного типа выполняют только гастрэктомию.
- Лимфодиссекция. Лимфогенное метастазирование при раке желудка происходит в 47,7 % случаев и зависит от глубины инвазии опухоли. Стандартно производят удаление лимфатических узлов 1 и 2 порядка. При наличии отдаленных метастазов выполняются паллиативные вмешательства.
Комбинированная адъювантная химиотерапия проводится по схемам XELOX (CAPOX) через 4–6 недель после операции при отсутствии тяжелых осложнений и после нормализации клинико-лабораторных показателей. В схемы включены препараты капецитабин и оксалиплатин.
Неоадъювантная химиотерапия проводится 3 курсами режимами CF (Цисплатин, 5-ФУ), ECF (Эпирубицин, Доксорубицин, Цисплатин, 5-ФУ), ECX (Эпирубицин, Доксорубицин, Цисплатин, Капецитабин) или EОХ (Эпирубицин, Доксорубицин Оксалиплатин), затем если опухоль резектабельна, то выполняют операцию, после которой назначают дополнительно 3 цикла аналогичной химиотерапии. Периоперационная химиотерапия является альтернативой послеоперационной химиолучевой терапии при операбельном раке желудка при лимфодиссекции по результатам проведенных исследований, так как способствует увеличению пятилетней выживаемости.
При местно-распространенном нерезектабельном и диссеминированном раке желудка и пищеводно-желудочного соустья назначается системная химиотерапия. Выбор конкретной комбинации зависит от состояния пациента, характера и тяжести сопутствующих заболеваний. В частности, режимы CF, CX, XELOX, IF (1a), FOLFOX продемонстрировали статистически достоверное увеличение выживаемости больных, в отличие от монокомпонентного лечения.
Симптоматическая терапия направлена на купирование осложнений. При кровотечении выполняется эндоскопическая остановка кровотечения.
Опухолевый стеноз устраняется путем бужирования или реканализации, баллонной дилатацией, установкой саморасправляющегося стента в зону стеноза. При невозможности проведения данных процедур выполняются гастроеюностомия, паллиативная гастрэктомия, чрезкожная эндоскопическая или интервенционная гастростомия у пациентов с дисфагией, эндоскопическая или хирургическая еюностомия у пациентов со стенозами на уровне средней и нижней трети желудка. Боль купируется дистанционной лучевой или медикаментозной терапией. Также возможно применение регионарной анестезии. Асцит купируется с помощью диуретиков, лапароцентеза, внутрибрюшным введением цисплатина.
Наиболее высокая пятилетняя выживаемость наблюдается после радикальных операций по поводу неинвазивных опухолей высокой степени дифференцировки и не затрагивающих метастазами региональные лимфоузлы.
Таким образом отсутствие патогномоничных симптомов для ранних форм и широкая распространенность H. pylori в популяции позволяют раку желудка оставаться на лидирующих позициях по заболеваемости и смертности в России, несмотря на появление более современных методов лечения.

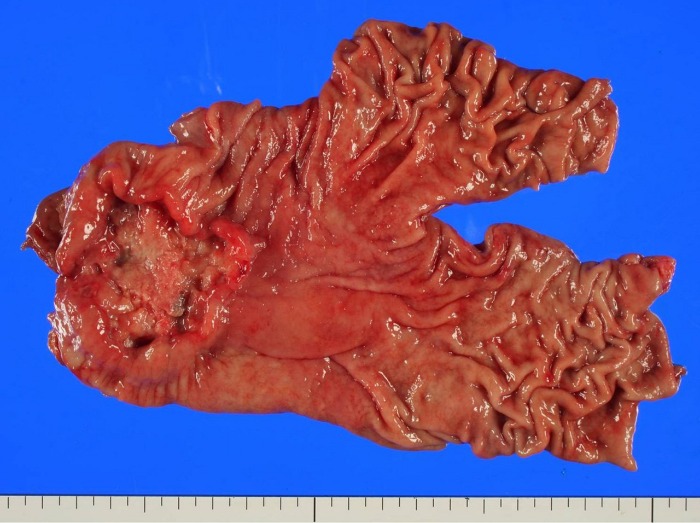
Полиповидный рак желудка с кровоизлиянием в центре опухоли. Рак расположен в антральном отделе по малой кривизне желудка.
Источники
- Чиссов В. И. и др. Злокачественные новообразования в России в 2010 году (заболеваемость и смертность) //М.: ФГБУ «МНИОИ им. ПА Герцена» Минздравсоцразвития России. – 2012. – С. 12.
- Маев И. В., Зайратьянц О. В., Кучерявый Ю. А. Кишечная метаплазия слизистой оболочки желудка в практике гастроэнтеролога: современный взгляд на проблему //Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2006. – Т. 16. – №. 4. – С. 38-47.
- Харнас С. С., Левкин В. В., Мусаев Г. Х. Рак желудка (клиника, диагностика, лечение): Учеб. пос. для студентов //М.: Изд. дом “Русский врач. – 2006.
- https://vk-cc.com/FPDGQC
- https://vk-cc.com/pDw45jl
- https://vk-cc.com/Pnyovkr
- https://vk-cc.com/skU7LdXw
- https://vk-cc.com/Pfu36JGn
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
