Прободная язва желудка рак
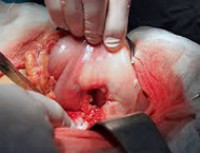
 Частота перехода язвы в рак составляет, по мнению большинства авторов, около 5-7% всех случаев язвы желудка (А. В. Мельников, Я. О. Гальперн и др.). Статистические данные в этом отношении, как и при других осложнениях, колеблются от 1-2 до 30%. По данным А. И. Абрикосова, переход язвы в рак наблюдается у 10% больных.
Частота перехода язвы в рак составляет, по мнению большинства авторов, около 5-7% всех случаев язвы желудка (А. В. Мельников, Я. О. Гальперн и др.). Статистические данные в этом отношении, как и при других осложнениях, колеблются от 1-2 до 30%. По данным А. И. Абрикосова, переход язвы в рак наблюдается у 10% больных.
С диагностической точки зрения важно, что в рак переходит только язва желудка, чаще антрального, пилорического и субкардиального отделов, реже малой кривизны. Чаще переход в рак наблюдается при длительно протекающей язвенной болезни. Последнее положение должно приниматься с некоторой -оговоркой, так как анамнез не всегда отражает давность язвы.
Диагностика язвы желудка, переходящей в рак, нередко представляет большие трудности. Также у больного могут быть проблемы с трудоустройством. Известно, что даже во время операции не всегда возможно решить, имеется ли у больного язва, рак или даже сифилитическая гумма. Нередко этот вопрос решается только после гистологического исследования ткани -по наличию атипичного разрастания желез в краях или в одном каком- нибудь крае язвенного дефекта. Критерием переходя язвы в рак должна быть совокупность клинических данных, делающих предположение о злокачественном новообразовании наиболее вероятным. Каждый в отдельности из перечисленных ниже признаков далеко не абсолютен, но многие из них в -различных сочетаниях имеют бесспорное значение.
С. С. Юдин очень образно указал на некоторые элементы клинической картины язвенной болезни, которые должны заставить врача подумать о возможности перехода в рак. Он подчеркивает, что чем больше язва, чем глубже ниша, чем старше больной, чем ниже кислотность, тем больше данных за наличие или возможность ракового перерождения. И действительно, на возможность развития рака желудка у больного, страдающего язвенной болезнью, указывает прежде всего длительность заболевания и возраст больного, приближающийся к среднему и пожилому, изменение характера болей, иногда их нарастание, довольно быстро прогрессирующее падение секреторной функции желудка и в ряде случаев значительное увеличение количества связанной соляной кислоты; не исчезающая, несмотря на лечение, (скрытая кровь в кале как находка постоянная или интермиттирующая; быстро нарастающие явления двигательной недостаточности желудка при локализации процесса в пилорическом отделе; тпохромная анемия, неи^рофильный лейкоцитоз, ускорение РОЭ, безрезультатность лечения, а также данные рентгенологического исследования. Подозрительными в отношении возможности перехода язвы в рак являются язвы желудка, длительно и упорно не заживающие, чаще каллезные, особенно локализующиеся в верхней и нижней трети малой кривизны желудка.
При рентгенологическом исследовании на медицинском оборудовании определяются (большие размеры язвы и увеличение ее, несмотря на (проведенное лечение, неровность контуров ниши, выраженный воспалительный вал (вокруг ниши, .плотный, .пальпирующийся и увеличивающийся, потеря радиарной очерченности, ригидность стенки.
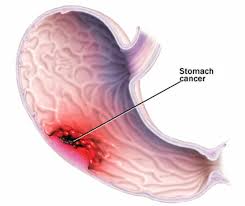 Существует известная зависимость между величиной язвы и частотой ее перехода в рак. Язвы размером до 2,5 см переходят в рак в 20% случаев, больше 3 ом – в 80%. Это положение необходимо принять с оговоркой: если язва развивается или обостряется на фоне дистрофии или гипотрофии, этот признак не имеет значения.
Существует известная зависимость между величиной язвы и частотой ее перехода в рак. Язвы размером до 2,5 см переходят в рак в 20% случаев, больше 3 ом – в 80%. Это положение необходимо принять с оговоркой: если язва развивается или обостряется на фоне дистрофии или гипотрофии, этот признак не имеет значения.
Играет роль также ширина входа язвы, а не ее глубина. Плоские и широкие ниши более подозрительны, чем глубокие и узкие. Воспалительный вал наблюдается и при каллезной язве, но в этом случае в нем обычно (хотя и не всегда) бывают видны складки слизистой.
При язве, переходящей в рак, вал вокруг ниши не только увеличивается, но и утрачивает исчерпанность, складчатость. Однако наличие складок и их конвергенция не исключают возможности перехода в рак, который иногда развивается параллельно рубцеванию язвы (П. Д. Тарнопольская). Выпадение перистальтической волны в области язвы может наблюдаться при воспалительной инфильтрации стенки желудка на .почве язвы, а также при раке.
У больных с перерождением язвы в рак ахилия обнаруживается примерно следующая: у 50% пониженная кислотность, у 9-10% нормальная и повышенная у 40%. Для диагноза рака имеет значение характер тромбоцитограммы (Л. С. Русинов).
Источник
Прободная язва желудка – сквозное повреждение стенки желудка, возникающее на месте острой либо хронической язвы. Данное состояние относится к симптомокомплексу «острого живота». Клинически проявляется интенсивной болью в животе, доскообразным напряжением передней брюшной стенки, лихорадкой, тахикардией, рвотой. Поставить правильный диагноз помогут эзофагогастродуоденоскопия, УЗИ и КТ органов брюшной полости, обзорная рентгенография органов брюшной полости, диагностическая лапароскопия. Лечение преимущественно хирургическое, дополняется антисекреторной, дезинтоксикационной и антихеликобактерной терапией.
Общие сведения
Прободная язва желудка формируется в основном у лиц трудоспособного и пожилого возраста. К счастью, данное осложнение встречается достаточно редко – не более двух случаев на 10000 населения. Несмотря улучшение диагностики и усовершенствование антихеликобактерной терапии, частота перфораций при язвенной болезни с годами увеличивается. Среди всех осложнений язвенной болезни желудка перфоративная язва занимает не менее 15%, а в целом это состояние развивается у каждого десятого пациента с язвенным анамнезом. Среди больных с перфорацией желудка язвенного генеза мужчин в десять раз больше, чем женщин. Прободение желудка является одной из основных причин смертности при язвенной болезни. Исследования в области гастроэнтерологии показывают, что прободение язвы желудка развивается в три раза чаще, чем перфорация язвы ДПК. Ретроспективный анализ историй болезни указывает на то, что около 70% прободных язв являются «немыми», т. е. до перфорации никак клинически не проявляются.

Прободная язва желудка
Причины
К факторам риска данного состояния принадлежат наличие острой или хронической язвы желудка, верифицированную хеликобактерную инфекцию (у 60-70% пациентов). К более редким причинам формирования прободной язвы желудка относят нарушение деятельности желез внутренней секреции, атеросклероз, недостаточность кровообращения, тяжелые дыхательные расстройства с развитием ишемии внутренних органов.
Прободная язва желудка протекает в три стадии. Начальная стадия длится до 6 часов после прободения; в этой фазе кислый сок из желудка попадает в брюшную полость, вызывая сильное химическое повреждение брюшины, проявляющееся внезапной интенсивной болью в животе. Вторая фаза (6-12 часов после прободения) характеризуется интенсивной продукцией экссудата, который разбавляет соляную кислоту, что приводит к уменьшению боли в животе. В третьей фазе (от 12 часов до суток после прободения) развивается гнойный перитонит, формируются межкишечные абсцессы.
Прободные язвы желудка классифицируют по:
- этиологии (прободение хронической или острой язвы);
- расположению (на кривизне желудка, в антруме, кардии либо пилорусе, теле желудка);
- клинической форме (классическая – прорыв в свободную брюшную полость; нетипичная – в сальник, клетчатку забрюшинного пространства, отграниченную спайками полость; комбинация с желудочным кровотечением);
- стадии перитонита (химического, бактериального, разлитого гнойного).
Симптомы прободной язвы желудка
Прободной язве желудка присущи несколько признаков: язвенная болезнь желудка в анамнезе, внезапная интенсивная боль в животе, доскообразное напряжение брюшной стенки, значительная болезненность при пальпации живота. При опросе примерно каждый пятый пациент отмечает усиление болей в желудке за несколько дней до перфорации. Иррадиация боли зависит от положения прободной язвы желудка: в руку (плечо и лопатку) справа при пилородуоденальной язве, слева – при расположении дефекта в области дна и тела желудка. При прорыве язвы задней стенки желудка соляная кислота изливается в клетчатку забрюшинного пространства или сумку сальника, поэтому болевой синдром практически не выражен.
При осмотре обращает на себя внимание вынужденное положение с приведенными к животу коленями, страдальческое выражение лица, усиление боли при движениях. Поперечные борозды на прямых мышцах живота становятся более выраженными, происходит втягивание живота на вдохе (парадоксальное дыхание). Артериальная гипотония сопровождается брадикардией, одышкой. В первые часы заболевания отмечается выраженная болезненность при пальпации в эпигастральной области, которая в последующем распространяется на всю переднюю брюшную стенку. Симптомы раздражения брюшины резко положительные.
Диагностика
Всем пациентам с подозрением на прободную язву желудка показана ургентная консультация гастроэнтеролога и хирурга. Цель всех инструментальных исследований и консультаций (в том числе и врача-эндоскописта) – выявление свободной жидкости и газа в брюшной полости, язвенного дефекта и перфоративного отверстия.
Обзорная рентгенография органов брюшной полости в вертикальном и боковом положении позволяет выявить свободный газ в брюшной полости, серповидно расположенный над печенью или под боковой стенкой живота. Данное исследование информативно в 80% случаев. Для более точной диагностики используют КТ органов брюшной полости (98% информативности) – позволяет обнаружить не только свободную жидкость и газ, но и утолщение желудочной и дуоденальных связок, непосредственно саму прободную язву желудка.
Во время проведения УЗИ органов брюшной полости рекомендуется визуализировать не только газ и жидкость в брюшной полости, но и гипертрофированный участок желудочной стенки в области прободной язвы желудка. Ультразвуковое исследование является одним из самых точных и доступных методов выявления прикрытых перфораций.
Эзофагогастродуоденоскопия дает возможность установить диагноз прободной язвы желудка у девяти пациентов из десяти. Проведение ЭГДС особо показано больным с подозрением на прободную язву желудка, у которых не выявляется пневмоперитонеум (свободный газ в брюшной полости) во время рентгенографии – нагнетание воздуха в желудок во время исследования приводит к выходу газа в брюшную полость и положительным результатам повторного рентгенологического исследования. ЭГДС позволяет визуализировать двойные перфорации, кровотечение из язвенного дефекта, множественные изъязвления, малигнизацию язвы желудка. Также фиброгастроскопия помогает определить оптимальную тактику хирургического вмешательства.
Диагностическая лапароскопия является самым чувствительным методом обнаружения прободной язвы желудка, газа и выпота в свободной брюшной полости. Данное исследование показано всем пациентам с сомнительными выводами уже проведенных обследований (рентгенографии, УЗИ, ЭГДС, КТ органов брюшной полости). Дифференцировать прободную язву желудка необходимо с острым аппендицитом, холециститом, панкреатитом, аневризмой брюшной аорты, инфарктом миокарда.
Лечение прободной язвы желудка
Целью терапии прободной язвы желудка является не только спасение жизни пациента и устранение дефекта в стенке желудка, но и лечение язвенной болезни желудка, разлитого перитонита. В практике гастроэнтеролога и хирурга встречаются случаи консервативного ведения прободной язвы желудка. Консервативное лечение используется только в двух случаях: при декомпенсированной соматической патологии и категорическом отказе больного от операции. Условия для проведения консервативного лечения: менее двенадцати часов от перфорации, возраст не более 70 лет, отсутствие напряженного пневмоперитонеума, стабильная гемодинамика. В комплекс консервативного лечения включают обезболивание, введение антибиотиков и антисекреторных препаратов, антихеликобактерную и дезинтоксикационную терапию.
В оперативном лечении прободной язвы желудка выделяют три основных подхода: закрытие перфорации, иссечение язвы желудка, резекция желудка. У большей части пациентов осуществляется закрытие перфорации путем его тампонады, прикрытия сальником или ушивания. Показания к закрытию прободной язвы желудка: бессимптомная перфорация, длительность заболевания более 12 часов, наличие признаков перитонита, крайне тяжелое состояние пациента. Начало лечения позже, чем через сутки от перфорации, в три раза увеличивает летальность. Улучшить результаты операции по закрытию перфорации позволяет антихеликобактерная и антисекреторная терапия в послеоперационном периоде.
Иссечение прободной язвы желудка производится только у каждого десятого больного. Данная операция показана при наличии стеноза желудка, кровотечения, язвы с каллезными краями, больших размеров перфорации, при подозрении на малигнизацию язвы (иссечение нужно для проведения патоморфологического исследования).
Резекция желудка может производиться у пациентов с прободной язвой при невозможности осуществления более простой операции и проведения послеоперационной антихеликобактерной и антисекреторной терапии. Обычно такие показания возникают при осложненном течении язвенной болезни (калезная, пенетрирующая и пептическая язва; множественные язвы), подозрении на злокачественный процесс, повторной перфорации язвы желудка, огромных размерах перфоративного отверстия (более 2 см).
Примерно у 10% пациентов применяются малоинвазивные методики хирургического вмешательства: лапароскопическое и эндоскопическое лечение язвы желудка. Использование лапароскопических операций позволяет достоверно снизить частоту послеоперационных осложнений и летальности. Различные методики операций могут комбинироваться между собой (например, лапароскопические с эндоскопическими) и с ваготомией (селективная проксимальная ваготомия, стволовая ваготомия, эндоскопическая ваготомия).
Если во время операции ваготомия не проводилась, в послеоперационном периоде назначается противоязвенная терапия (ингибиторы протонной помпы и блокаторы Н2-гистаминовых рецепторов, антихеликобактерные препараты).
Прогноз и профилактика
Прогноз при прободной язве желудка зависит от многих факторов. Риск летального исхода значительно повышается при возрасте пациента старше 65 лет, тяжелой сопутствующей патологии (онкозаболевания, СПИД, цирротическая трансформация печени), больших размерах перфоративного отверстия, длительном анамнезе прободной язвы желудка до операции. 70% летальных исходов при язвенной болезни желудка обусловлены прободной язвой желудка. Единственным методом профилактики данного состояния является своевременное выявление и лечение язвенной болезни желудка.
Источник
Сложным и весьма дискутабельным вопросом является выбор объема операции при мотивированном подозрении на злокачественный характер кровоточащей или перфоративной язвы желудка. По данным отечественных и зарубежных авторов частота желудочных язв, имеющих злокачественный характер (малигнизация, первично-язвенная форма рака, изъязвление инфильтративного рака) может достигать 15 – 20%. Очевидно, что получение морфологического подтверждения злокачественности желудочной язвы в неотложной ситуации практически невозможно. Однако, эндоскопические признаки (обширность – более 2,5 см в диаметре – и глубина изъязвления, локализация ближе к большой кривизне, неровные (бугристые) приподнятые и ригидные края язвы, инфильтрация стенки желудка и отсутствие перистальтики в периульцерозной зоне), а также данные интраоперационной ревизии (инвазия серозного покрова в области язвы, инвазия в окружающие анатомические структуры, каменистая плотность самого язвенного кратера и ригидность желудочной стенки в периульцерозной зоне, увеличение регионарных лимфоузлов) позволяют хирургу с высокой вероятностью предположить наличие онкопроцесса. На возможность выполнения радикальных с онкологических позиций оперативных вмешательств в неотложной хирургии гастродуоденальной зоны существуют две диаметрально противоположные точки зрения. Согласно первой из них операции, проводимые по поводу жизнеугрожающих состояний (кровотечения и перитонита) должны выполняться в минимальном объеме, достаточном для сохранения жизни больному. Согласно другой точке зрения любое подозрение на наличие онкопроцесса является автоматическим показанием к выполнению адекватного с точки зрения онкологической радикальности максимально расширенного вмешательства. Обе точки зрения формально правомочны. Однако такая «формальная правомочность» в первом случае обрекает каждого пятого пациента на гибель от прогрессирования онкопроцесса в отдаленном послеоперационном периоде при, как правило, гладком ближайшем послеоперационном периоде после вмешательств малого объема. Будем откровенны: мало кто из хирургов, после проведенной стандартной резекции 2/3 желудка и впоследствии установленной патоморфологом злокачественности язвы, предпримет повторное вмешательство с целью увеличения объема резекции и проведения лимфаденэктомии. Во втором случае «формальная правомочность» онкологической точки зрения предполагает выполнения всем пациентам с подозрением на злокачественный характер язвы максимально высокой резекции, вплоть до гастрэктомии, и лимфаденэктомии в объеме D2 – D3. Как известно, противопоказания к операциям по поводу злокачественных новообразований в онкологии считаются весьма относительными. Очевидно, что обе представленные точки зрения с позиций здравого смысла оказываются неприемлемыми: истина находится посередине.
Ключевыми вопросами в определении принципиальной возможности проведения онкологически радикальных вмешательств при подозрении на малигнизацию кровоточащих или перфоративных язв желудка являются: возможность расширенной операции при кровотечении или перитоните, необходимый и достаточный объем резекции, минимально допустимый объем лимфаденэктомии. Обсуждая вопрос о тяжести состояния пациентов с кровоточащей язвой (?), допускающей проведение расширенной операции, следует сразу же подчеркнуть, что некорригированная кровопотеря, продолжающееся кровотечение и, особенно, его рецидив, преклонный возраст больного и выраженная сопутствующая патология исключают выполнение у таких пациентов онкологически радикальных операций. Очевидно, что в данной ситуации вопросы лечебной тактики и главный из них – определение оптимальных сроков вмешательства – имеют первостепенное значение. Как указывалось выше, именно дифференцированная лечебная тактика при ОГДЯК на основании прогнозирования рецидива кровотечения и объективной оценки тяжести состояния больного предполагает проведение операции в оптимальные сроки (в безрецидивный период) и при адекватно корригированных нарушениях гомеостаза, что и определяет возможность выполнения резекционных вмешательств в данной ситуации. Хотим еще раз подчеркнуть, что предполагаемая к проведению в неотложном порядке операция большого объема облигатно требует полной компенсации волемических и гемических расстройств (критерии адекватности предоперационной подготовки – см. выше). Даже при наличии признаков неустойчивого гемостаза необходимо пролонгирование безрецидивного периода средствами эндоскопического гемостаза до окончания предоперационной подготовки.
При перфорации подозрительных на злокачественные язв желудка, факторами, исключающими возможность проведения онкологически радикальной операции, являются: признаки СПОН, гнойный характер перитонита, МИП выше 20, IV – V степень операционно-анестезиологического риска. При отсутствии указанных факторов и среднетяжелом состоянии пациента имеющиеся при фибринозном перитоните в любом случае интоксикация и волемические нарушения подвергаются коррекции в ходе кратковременной интенсивной предоперационной подготовки, что делает возможным проведение расширенных резекционных вмешательств при предполагаемом злокачественном характере перфоративной язвы. Тем не менее, окончательное решение о возможности расширения объема операции при ПГДЯ принимается на основании интраоперационной оценки характера и распространенности перитонита.
В противоположность распространенной во второй половине XX столетия точке зрения о необходимости тотальной гастрэктомиии при любой распространенности злокачественного процесса в желудке, в настоящее время имеются объективные доказательства того, что радикальность в большей степени зависит не от объема резекции, а от качества выполненной лимфаденэктомии и того, что результаты субтотальной резекции желудка с адекватной лимфаденэктомией ничуть не хуже результатов гастрэктомий. Кроме того, непосредственные (осложнения и летальность) и отдаленные (нарушение пищеварения и обмена) результаты гастрэктомий принципиально хуже таковых для субтотальной резекции. Учитывая, что в подтвердившиеся подозрения злокачественного характера кровоточащих или перфоративных язв в большинстве случаев оказываются либо локусами малигнизации в каллезной язве, либо изъязвленной опухолью с приподнятыми краями (II тип по Borrmann), опухолевая инфильтрация желудочной стенки распространяется на незначительное расстояние. Из этого следует возможность проведения при данном типе опухоли резекции с верхней границей, проходящей не более чем на 5 см проксимальнее пальпаторно определяемой границы опухоли. На практике это означает, что объем субтотальной резекции будет являться достаточным при локализации малигнозированной язвы или изъязвленной опухоли в антральном отделе, в нижней и, частично, средней трети тела желудка. При расположении подозрительной на злокачественную язвы в верхней трети тела и выше радикальным объемом операции будет являться гастрэктомия (возможность ее проведения в экстренной ситуации составляет предмет отдельной дискуссии и в данной работе не обсуждается). При наличии выраженного инфильтративного компонента (инфильтративно-язвенная форма рака, III тип по Borrmann), когда проксимальная граница резекции должна проходить не менее, чем на 10 см проксимальнее верхнего края опухоли, субтотальное удаление желудка возможно только при локализации процесса ниже угла желудка, то есть в антральном отделе. Таким образом, преимущественная локализация кровоточащих и перфоративных язв в антральном отделе желудка определяют возможность, при подозрении на злокачественный характер язвы, проведения адекватного с точки зрения радикальности (R0) оперативного вмешательства – субтотальной резекции желудка. C. Wu et al. (2003) указывают, что радикальность субтотальной резекции определяется полным удалением малой кривизны и расширенной лимфаденэктомией. В противоположность широко распространенному мнению о невозможности завершения выполненной по онкологическим показаниям субтотальной резекции гастро-дуоденоанастомозом и необходимости реконструкции только по Бильрот-II авторы, предметно занимающиеся изучением хирургии рака желудка (А.Ф. Черноусов, 2004; Yokota T., 2003; Maruyama K., 1985), аргументированно указывают на безосновательность подобных предубеждений. При правильно проведенной встречной мобилизации желудка и ДПК гастро-дуоденоанастомоз формируется без особых технических затруднений. По данным тех же авторов частота выполнения при дистальном раке субтотальных резекций желудка по Бильрот-I в некоторых японских клиниках достигает 70%. Предубеждение против резекции желудка по Бильрот-I при дистальном раке (и необходимость формирования гастро-энтероанастомоза только по методу Бальфура) некоторые хирурги оправдывают некой гипотетической возможностью возникновения в отдаленном периоде непроходимости вследствие компрессии ДПК или отводящей петли при резекции по Ру увеличенными регионарными лимфоузлами при их метастатическом поражении. Мы не смогли найти доказательств данной гипотетической возможности как в классических, так и в современных работах. Более того, указанная позиция нам представляется психологически связанной с отсутствием у хирурга стремления к выполнению радикального вмешательства, что объяснимо, в лучшем случае, некой «онкологической обреченностью». Отношение некоторых коллег к прогрессированию опухолевого процесса как к неизбежному и фатальному злу является исключительно личной прерогативой каждого и не должно служить объективной предпосылкой к отказу от выполнения принятого как во всем мире, так и в специализированных отечественных клиниках объема операции при дистальном раке желудка – субтотальной резекции с регионарной лимфаденэктомией.
Несмотря на то, что онкологами постулируется облигатная необходимость выполнения лимфаденэктомии желательно в максимально возможном объеме, предусматривающим лимфодиссекцию D3, возможность расширения неотложной операции диссекцией периваскулярных клетчаточных пространств, включая аорто-кавальный промежуток, должна рассматриваться с позиций здравого смысла. А именно – с позиций эффективности и безопасности. Безусловно, само по себе удаление лимфатических узлов и периваскулярной клетчатки не является экзогенным воздействием, сопоставимым по влиянию на организм, например, с полным удалением желудка. Однако, сама продолжительность лимфодиссекции D2 – D3, сравнимая по времени с основным этапом операции, длительность послеоперационной лимфорреи, потенциальный риск возникновения острого панкреатита, абсцессов при недренируемых скоплениях лимфы являются весьма существенными факторами, ограничивающими применение лимфаденэктомии в хирургии вообще, и в неотложной хирургии – особенно. Тем не менее, лимфаденэктомия в объеме не менее D2, по мнению большинства исследователей, является в настоящее время обязательным условием радикального вмешательства при раке желудка любой локализации (А.Ф. Черноусов, 2002; М.И. Давыдов, 2001; В.И. Чиссов, 1996; Sasako M., 1997). При этом позитивный эффект лимфаденэктомии проявляется не только при наличии макро- и микроскопически определяемых метастазов в регионарные лимфоузлы, поскольку у значительной части пациентов (по T. Okamura, 1988 – до 20%) с гистологически неизмененными лимфоузлами методами иммуногистохимии в них выявляются микрометастазы. Клиническая эффективность лимфаденэктомии в настоящее время (как при N0, так и при N1-N2) является твердо установленным фактом. Не ставя себе целью подробное рассмотрение данной проблемы, приведем лишь наиболее яркие доказательства. Так, D. Roukos (1998) продемонстрировал, что, увеличивая количество радикально оперированных больных на 25%, лимфаденэктомия D2 увеличивает 5-летнюю выживаемость при N0 до 71%, при N1 – до 53%, при N2 – до 17%. По данным F. Crucitti (1997) после лимфаденэктомии D1 5-летняя выживаемость составила 41,5%, после лимфаденэктомии D2 – 66,3%. Наилучшие результаты в плане 5-летней выживаемости после лимфаденэктомии D2 характерны для групп пациентов со II и IIIа стадиями рака желудка.
Не менее актуальным является обсуждение вопроса о непосредственных результатах лимфаденэктомии D1 и D2 в сравнении. Данные как японских (M. Sasako, 1997), так и европейских исследователей (J. Siewert, 1998) показывают, что достоверных различий в частоте послеоперационных осложнений (кровотечения, несостоятельности анастомозов, абсцессы, острый панкреатит) при диссекциях D1 и D2 нет. А.Ф. Черноусов и соавт. (2004) приводят данные о том, что расширение объема лимфодиссекции с D1 до D2 и даже D3 при субтотальной резекции желудка не влечет за собой статистически значимого увеличения числа послеоперационных осложнений и летальности. Тем не менее, те же авторы справедливо указывают, что расширенная (D3) лимфаденэктомия несет с собой большую операционную травму, снижает репаративные способности организма больного, длиться значительно дольше операции в стандартном объеме, что, в свою очередь, крайне негативно сказывается как на пациенте, так и на хирурге (усталость, снижение внимания и т.д.). Поэтому, учитывая и недостаточно четко сформулированные показания к лимфаденэктомии D3, и неоднозначность ее отдаленных результатов, применение операции в таком объеме в неотложной хирургии (тем более при подозрении на онкопроцесс) вряд ли целесообразно.
Согласно классификации регионарных лимфоузлов желудка по Japanese Re Society for Gastric Cancer при дистальной субтотальной резекции желудка с лимфаденэктомией D1 удаляются следующие группы лимфоузлов: правые паракардиальные (№1), малой кривизны (№3), левые желудочно-сальниковые (№ 4sb), правые желудочно-сальниковые (№4d), надпривратниковые (№5), подпривратниковые (№6). При дистальной субтотальной резекции желудка с лимфаденэктомией D2, помимо указанных групп удаляются лимфоузлы: левой желудочной артерии (№7), передние общей печеночной артерии (№8а), чревного ствола (№9), проксимальные селезеночной артерии (№10р), левые гепатодуоденальной связки (№12а).
Классификация метастазов в регионарные лимфоузлы (N1 – N3, M1) при локализации опухоли в антральном отделе и теле желудка по JRSGC.
Регионарные лимфоузлы желудка | Антрум | Тело | |
1 | Правые паракардиальные | 2 | 1 |
2 | Левые паракардиальные | М | 3 |
3 | Малая кривизна | 1 | 1 |
4sa | Короткие сосуды желудка | М | 3 |
4sb | A.gastroepiploica sin. | 3 | 1 |
4d | A.gastroepiploica dextr. | 1 | 1 |
5 | Надпривратниковые | 1 | 1 |
6 | Подпривратниковые | 1 | 1 |
7 | A. gastrica sin. | 2 | 2 |
8 | A.hepatica comm. | 2 | 2 |
9 | Truncus coeliacus | 2 | 2 |
10 | Ворота селезенки | М | 2 |
11p | A.lienalis (прокс.) | 2 | 2 |
11d | A.lienalis (дист.) | М | 2 |
12 | Lig.hepatoduodenale | 2-3 | 2-3 |
13 | Ретропанкреатические | 3 | М |
14v | V. mesenterica sup. | 2 | 3 |
14a | A.mesenterica sup. | М | М |
15 | A.colica | М | М |
16a1 | Hiatus aorticus, aortae bifur. | М | М |
16a2 | Средние парааортальные | 3 | 3 |
110 | Нижние околопищеводные | М | М |
111 | Наддиафрагмальные | М | М |
112 | Заднее средостение | М | М |
В нашем клиническом материале из 287 дистальных резекций желудка, проведенных по поводу кровоточащей или перфоративной язвы желудка (антральный отдел, нижняя треть тела желудка), операции по онкологическим принципам вследствие мотивированного подозрения на злокачественный характер процесса были проведены у 41 (14,3%) больного. При этом злокачественный характер процесса впоследствии был подтвержден гистологически у 33 больных, что составило 11,5% от всех случаев резекции по поводу язв желудка, осложненных кровотечением или перфорацией. Распределение больных по стадиям рака желудка на основании заключительных клинических диагнозов оказалось следующим: I стадия – 2 (6,1%) пациента, II стадия – 14 (42,4%) пациентов, IIIа стадия – 10 (30,2%) пациентов, IIIb стадия – 5 (15,2%) пациентов, IV стадия – 2 (6,1%) пациентов. Таким образом, подавляющее большинство (72,6%) из группы больных со злокачественным характером кровоточащей или перфоративной язвы составили больные со II и IIIа стадиями рака, то есть пациенты, для которых лимфодисекция в объеме D2 является максимально эффективной в плане 5-летней выживаемости. Из 41 субтотальной дистальной резекции желудка, когда подозревался злокачественный характер язвы, лимфаденэктомия D1 была произведена в 18 случаях, лимфаденэктомия D2 – в 15 случаях. С сожалением приходится признать, что максимум 15 (62,5%) из 24 пациентов, которым лимфаденэктомия D2 была показана, были оперированы радикально. Объективных противопоказаний к расширению объема резекции до лимфаденэктомии D2 (тяжесть состояния пациента по совокупности факторов) у остальных 37,5% пациентов при ретроспективном анализе ни в одном случае выявлено не было. Следовательно, отказ от проведения онкологически радикального вмешательства был обусловлен исключительно субъективными факторами. По своим непосредственным результатам субтотальная дистальная резекция желудка по Бильрот-I с лимфаденэктомией D2 достоверно не отличалась от среднего показателя для резекций желудка по Бильрот-I при ОГДЯК и ПГДЯ: частота послеоперационных осложнений составила 8,4% vs. 6,9% и 5,3% соответственно; летальных исходов в этих группах пациентов не было. Таким образом, при мотивированном подозрении на злокачественный характер кровоточащей или перфоративной язвы желудка и адекватном для проведения резекционного вмешательства состоянии пациента необходимо и возможно проведение радикальной операции в объеме субтотальной дистальной резекции желудка с лимфаденэктомией D2.
Статья добавлена 14 апреля 2016 г.
Источник
