Полиморфноклеточная инфильтрация слизистой желудка
В
настоящее время доказана ассоциация рака желудка кишечного типа с
Helicobacter
pylori-инфекцией.
Наличие этой ассоциации обусловлено развитием хронического гастрита в
ответ на колонизацию слизистой оболочки желудка (СОЖ) H.pylori
[1]. Длительная персистенция клеток воспалительного инфильтрата,
наблюдающаяся при хроническом H.pylori-ассоциированном
гастрите, оказывает повреждающее воздействие на эпителиоциты СОЖ,
отражением чего служит появление в СОЖ атрофических изменений.
Дальнейшее повреждение генома эпителиоцитов приводит к возникновению
в СОЖ, наряду с атрофическими изменениями, дисплазии/неоплазии, а
затем и рака желудка кишечного типа [1, 2]. Поэтому важное значение
приобретает не только оценка атрофических изменений СОЖ и
выраженности воспаления, но и состава воспалительного инфильтрата,
который на сегодняшний день недостаточно исследован. Уровень
воспалительного ответа в значительной степени определяется
полиморфизмом генов цитокинов [3]. Носительство полиморфных аллелей
генов цитокинов определяет риск развития рака желудка кишечного типа,
при этом он значительно варьирует в различных исследуемых популяциях
[4].
Таким
образом, результаты исследования особенностей воспалительной реакции
в слизистой оболочке желудка, в дальнейшем могут позволить оценить
индивидуальный риск развития рака желудка кишечного типа у
обследуемого пациента.
Цель
исследования:
Определить особенности состава воспалительного инфильтрата слизистой
оболочки желудка и полиморфизма генов цитокинов, регулирующих
воспаление, для оценки факторов риска рака желудка кишечного типа.
Материалы и методы.
Объектами
исследования были фрагменты слизистой оболочки желудка и венозная
кровь 82 больных раком желудка кишечного типа, находившихся на
лечении в Омском клиническом онкологическом диспансере.
Морфологическому
исследованию подвергались фрагменты слизистой оболочки резецированных
желудков, забранные из 5 точек: большой и малой кривизны антрального
отдела и тела желудка и угла желудка. Отдельно производился забор
фрагментов ткани опухоли. Морфологическая оценка производилась в
соответствии с Российским пересмотром классификации хронического
гастрита OLGA.
Иммуногистохимическое
исследование выполняли на парафиновых срезах. Демаскировка антигенов
осуществлялась в цитратном буфере (pH=6,0)
при кипячении в водяной бане на протяжении 1 часа. Использовались
первичные мышиные моноклональные антитела CD4,
CD8,
CD20,
CD68
производимые «DAKO»
и система визуализации «Histofine».
Ядра докрашивались гематоксилином Майера. Подсчет проводился на 1000
клеток, вычислялось процентное их соотношение.
При помощи
метода полимеразной цепной реакции в аллель-специфической и
ПДРФ-модификациях определялось носительство полиморфных аллелей генов
IL-1β
C+3953T (rs1143634) и C-511T
(rs16944), TNF-α
G-308A
(rs1800629), IL-10
G-1082A
(rs1800896) и вариабельное число тандемных повторов в интроне 2 гена
IL-1RN.
ПЦР проводилась с использованием коммерческих наборов реагентов
«SNP-экспресс»,
производимых НПФ «Литех» и ИХФБМ СО РАН. Этапы
амплификации ДНК выполнялись в соответствии с требованиями,
указываемыми производителем. Детекцию продуктов амплификации
осуществляли в 3% агарозном геле. В исследуемой группе определялось
соответствие соотношения частот аллелей равновесию Харди-Вайнберга.
Для
статистической оценки полученных результатов вычислялись U-критерий
Манна-Уитни и критерий Краскелла-Уоллиса (H).
Вычисления и построение диаграмм проводились с помощью пакета
статистических программ Statistca 6.0 и Microsoft Excel 2007.
Результаты
и обсуждение.
Плотность
мононуклеарной инфильтрации варьировала в пределах от умеренной до
выраженной. При оценке состава мононуклеарного воспалительного
инфильтрата было выявлено преобладание CD4+
Т-лимфоцитов, диффузно инфильтрировавших собственную пластинку СОЖ,
доля которых составила в антруме 44,1±8,8% и 35,6±3,2%
в теле желудка. С несколько меньшей частотой встречались CD8+
Т-лимфоциты (21,5±6,1% и 16,2±2,2% в антральном отделе
и теле желудка, соответственно). CD20+
В-лимфоциты локализовались в виде скоплений, вне этих скоплений их
плотность была низка, их доля составила в антральном отделе 6,3±1,1%
и 4,2±1,8% в теле желудка. CD68+
макрофаги составили 28,1±4,3% и 22,3±6,7% в антральном
отделе и теле желудка, соответственно, от общего числа мононуклеарных
клеток. При оценке состава воспалительного инфильтрата у больных с
различными показателями стадии и степени хронического гастрита было
выявлено, что доля CD20-позитивных
клеток в собственной пластинке слизистой оболочки коррелирует с
градацией воспаления в антральном отделе и теле желудка у больных
раком желудка кишечного типа (Н=14,8; p<0,05).
Рядом авторов было показано, что количество CD20-позитивных
B-лимфоцитов
в собственной пластинке СОЖ ассоциировано с H.pylori-инфекцией
и коррелирует с выраженностью морфологических проявлений гастрита у
детей, значительно снижаясь при эрадикации инфекта [8, 9].
По-видимому, увеличение доли CD20-позитивных
клеток, формирующих скопления, при более выраженном воспалении в
собственной пластинке СОЖ у больных раком желудка кишечного типа
может указывать на длительность течения воспалительной реакции
имеющей место также и после возможной спонтанной эрадикации инфекта.
Возможность сохранения воспалительного инфильтрата после эрадикации
H.pylori
показана на примере феномена эксхеликобактерного гастрита [10].
Кроме
того, было обнаружено, что в участках собственной пластинки слизистой
оболочки желудка, граничащих с зоной опухолевого роста, наблюдается
более выраженная инфильтрация CD8-
и CD68-позитивными
клетками, чем в антральном отделе и теле желудка (U=5,5;
p<0,05
и U=43,0;
p<0,05,
соответственно). Инфильтрация собственной пластинки слизистой
оболочки желудка CD8-
и CD68-позитивными
клетками, вероятно, является морфологическим проявлением
неспецифического иммунного ответа и ответа Th-1
типа, возникающего в ответ на развитие опухоли. Увеличение количества
цитотоксических лимфоцитов в зоне опухоли при раке желудка кишечного
типа показано J.
Chen
и соавторами [11]. Полученные ими результаты указывают на корреляцию
между долей CD8+
клеток и характеристиками опухоли по градации TNM
[11]. Отсутствие подобной корреляции в нашем исследовании может
объясняться оценкой характеристик воспалительного инфильтрата в
пограничном с опухолью участке СОЖ, а не в зоне опухолевого роста. В
данном случае отсутствует прямая зависимость между этими показателями
и увеличение доли CD8+
клеток может рассматриваться скорее как феномен, указывающий на
близкую локализацию опухоли.
При
исследовании генетического полиморфизма было выявлено, что
распределение частот аллелей в исследуемой и контрольная группах
соответствует равновесию Харди-Вайнберга. Поиск ассоциации между
морфологическими характеристиками изменений в СОЖ и носительством
исследуемых полиморфных аллелей генов цитокинов и генотипов с этими
аллелями показал, что наличие рака желудка кишечного типа при
атрофических изменениях слизистой оболочки желудка, соответствующих
стадии II
хронического гастрита ассоциировано с носительством генотипа -1082A/A
гена IL-10 (U=7,5;
p<0,05).
Носительство генотипа -1082A/A
гена IL-10 связано с меньшей экспрессией белка [12, 13]. Учитывая
биологические эффекты IL-10,
заключающиеся в подавлении воспалительного ответа, протекающего по
Th-1
типу [14], меньшая продукция IL-10,
по-видимому, обусловливает более выраженное повреждающее действие,
оказываемое клетками воспалительного инфильтрата на СОЖ, что
способствует, вероятно, быстрому протеканию каскада канцерогенеза в
СОЖ и появление аденокарциномы уже на стадии II
атрофических изменений СОЖ.
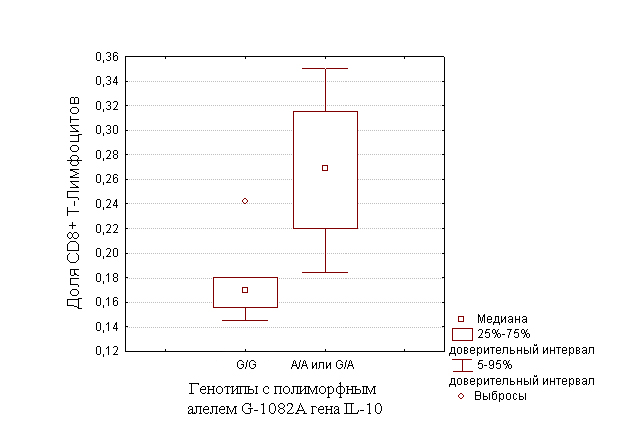
На
усиление ответа иммунного ответа, протекающего по Th-1
типу указывает тот факт, что доля CD8-позитивных
клеток в собственной пластинке слизистой оболочки антрального отдела
желудка больных раком желудка кишечного типа достоверно выше у
носителей гетерозиготного (-1082 G/A) и гомозиготного (-1082 A/A)
генотипов по полиморфному аллелю G-1082A гена IL-10, в сравнении с
носителями гомозиготного по нормальному аллелю генотипов (U=5,0;
p<0,05)
(рис.2)
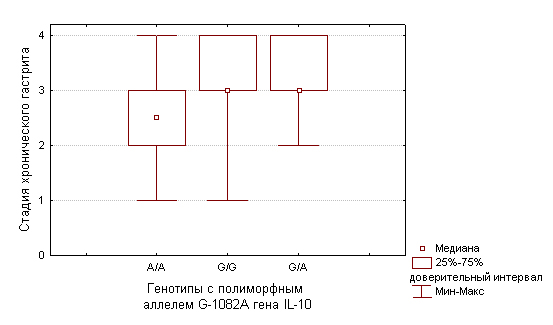
Рис.1.
Распределение стадии хронического гастрита у больных раком желудка
кишечного типа в зависимости от носительства генотипов с полиморфным
алелем G-1082A
гена IL-10.
.

Рис.2. Выраженность
инфильтрации СОЖ CD8-позитивными
клетками у носителей генотипов с полиморфным алелем G-1082A
гена IL-10.
Показатели
степени хронического атрофического гастрита и мононуклеарной
инфильтрации СОЖ в антральном отделе и теле желудка у больных раком
желудка кишечного типа коррелируют с количеством полиморфных аллелей
генов цитокинов у данного больного. Данная ассоциация, вероятно,
обусловлена более выраженным провоспалительным ответом и менее
выраженным его подавлением у носителей исследуемых полиморфных
аллелей.
Таким
образом, состав мононуклеарного воспалительного инфильтрата указывает
на сочетание в СОЖ при раке желудка кишечного типа двух типов
иммунного ответа: иммунного ответа протекающего по Th-2
типу, обусловленного инфильтрацией СОЖ CD20+
B-лимфоцитами
и служащего отражением процесса хронического воспаления и иммунного
ответа протекающего по Th-1
типу, являющегося как компонентом хронического восполения, так и
реакцией на опухолевый процесс, однако распространяющийся в СОЖ за
пределы опухоли на пограничные с ней участки. Для пограничных с зоной
опухолевого роста участков СОЖ характерна активация и
неспецифического иммунного ответа. Кроме того усиление
воспалительного ответа по Th-1
связано с носительством полиморфного аллеля -1082 A
гена IL-10.
Литература:
1) Кононов А.В. Воспаление
как основа Нelicobacter pylori – ассоциированных болезней /
А.В. Кононов // Архив патологии. – 2006. – №5. – С.
3-10.
2)
Konturek
P.C. Helicobacter pylori infection in gastric cancerogenesis /
P.C. Konturek,
S.J. Konturek, T.
Brzozowski
// Journal
of physiology and pharmacology. – 2009. – Vol. 60, №
3. – P. 3-21.
3)
Shanks A.M. Helicobacter pylori infection, host genetics and gastric
cancer / A.M.
Shanks , E.M. El-Omar // Journal of digestive diseases. –
2009. – Vol.10, №3. – P.157-164.
4)
Interleukin-1beta and interleukin-1 receptor antagonist gene
polymorphisms and gastric cancer: a meta-analysis. / M.C. Camargo [et
al.] // Cancer epidemiology, biomarkers & prevention: a
publication of the American Association for Cancer Research,
cosponsored by the American Society of Preventive Oncology. –
2006. – Vol.15, №9. – P.1674-1687.
5)Assessment
of Atrophic Gastritis Using the OLGA System / K. Satoh [et al.] //
Helicobacter. – 2008. – Vol. 13, №3. – P.
225–229.
6)
OLGA Gastritis Staging in Young Adults and Country-Specific Gastric
Cancer Risk
/ M. Rugge [et al.] // Int. J. Surg. Pathol. – 2008. –
Vol. 16, № 2. – P. 150–154.
7)
The
staging of gastritis with the OLGA system by using intestinal
metaplasia as an accurate alternative for atrophic gastritis / L. G.
Capelle
[et al.] // Gastrointest.
Endosc.
– 2010. – Vol. 71, №7. – P. 1150–1158.
8)
Helicobacter
pylori increases expression of proapoptotic markers Fas and FasL on
CD4 lymphocytes in children / A. Kotłowska-Kmieć
[et al.] // Acta biochimica Polonica. – 2009. –
Vol. 56, № 3. – P.433-438.
9)
B
(CD20+) lymphocytes in the antrum mucosa of children with
Helicobacter pylori infection / E. Maciorkowska
[et
al.]
//
Roczniki
Akademii
Medycznej
w
Białymstoku.
– 2004. – Vol.
49 № 1. P.
222-224.
10) Ливзан
М.А. Экс-хеликобактерный гастрит:
неологизм или клиническая реальность? / М.А. Ливзан, А.В.
Кононов, С.И. Мозговой // Экспериментальная и клиническая
гастроэнтерология. – 2004. – № 5.- С.
55 – 59.
11)
Intratumoral expression of il-17 and its prognostic role in gastric
adenocarcinoma patients /Ju-gao Chen // International Journal of
Biological Sciences. – 2011. – Vol. 7, № 1. P. 53-60.
12)
Smith A.J. Cytokine and cytokine receptor gene polymorphisms and
their functionality / A.J. Smith , S.E. Humphries
// Cytokine & growth factor reviews. – 2009. –
Vol.20, №1. – P.43-59.
13)
Interindividual variations in constitutive interleukin-10 messenger
RNA and protein levels and their association with genetic
polymorphisms / A. Suarez [et al.] // Transplantation. – 2003.
– Vol. 75, № 5. – P. 711-717.
14)
IL10 interleukin
10 [ Homo
sapiens ]
[Электронный ресурс]. – 2011. – Режим доступа:
https://www.ncbi.nlm.nih.gov/gene/3586.
Основные термины (генерируются автоматически): СОЖ, кишечный тип, рак желудка, воспалительный инфильтрат, собственная пластинка, слизистая оболочка желудка, хронический гастрит, иммунный ответ, клетка, полиморфная аллель генов.
Источник
Инфильтративный рак желудка — это морфологическая форма карциномы, для которой характерен инфильтративный рост (проростание сквозь стенку органа) и отсутствие четких границ опухоли.
Особенности инфильтративного рака:
- Характеризуется высокой степенью злокачественности — быстро растет и рано дает метастазы.
- Может встречаться у молодых людей.
- Хорошо прослеживается наследственный фактор.
- Как правило, манифестирует с симптомов диспепсии.
Причины возникновения
Причины возникновения инфильтративной формы рака желудка до конца неизвестны. Предполагается, что факторы риска аналогичны другим формам карциномы желудка:
- Хронический атрофический гастрит. Более чем у половины пациентов с раком желудка был диагностирован атрофический гастрит. При этом имеет значение его локализация. При поражении тела желудка, риск рака увеличивается в 3-5 раз, антрального отдела — в 18 раз, и если признаки атрофического гастрита обнаруживаются по всему желудку, риск развития злокачественного новообразования увеличивается в 90 раз.
- Нерациональное питание и употребление в пищу вредных продуктов. Сюда относят постоянное переедание, частое употребление в пищу маринадов, копченостей, вяленых, соленых и острых блюд, избыток в рационе жиров животного происхождения и жиров, подвергшихся термической обработке.
- Наследственная предрасположенность. Для инфильтративного рака желудка наследственный фактор прослеживается гораздо четче, чем для других форм злокачественных новообразований желудка. В пользу этого говорит и то, что опухоль часто диагностируется у молодых пациентов.
- Пьянство и алкоголизм.
- Курение.
- Хеликобактерная инфекция.
Кто входит в группу риска
Группу повышенного онкориска составляют следующие пациенты:
- С хроническим атрофическим гастритом.
- С хронической язвой желудка, особенно если она крупных размеров. Злокачественная трансформация может произойти на любом этапе язвенной болезни.
- Люди, в семье у которых были случаи рака желудка.
- Пациенты, перенесшие оперативные вмешательства на желудке в течение последних 10 лет.
- Пациенты с врожденными и приобретенными иммунодефицитами.
- Работники, занятые во вредных условиях труда, в частности на никелевых, асбестовых производствах, производстве резины, хрома и др.
- Пациенты с полипами на широком основании.
Вышеперечисленным категориям людей рекомендуется своевременно проходить медицинские осмотры с проведением фиброгастродуоденоскопии с взятием биопсии из патологических очагов. При морфологическом исследовании биоптата определяется наличие морфологических изменений: атипии клеток, структурных изменений ткани слизистой оболочки и др. Такие изменения должны расцениваться как предрак и должно проводиться соответствующее лечение.
Общие клинические проявления
Рак желудка на ранних стадиях не имеет типичных проявлений. Если симптомы и есть, то они неспецифичны и могут присутствовать при огромном количестве других заболеваний:
- Изменение общего состояния пациента — повышенная утомляемость, непонятная слабость, снижение работоспособности.
- Нарушение настроения, вплоть до депрессии — апатия, отчужденность, потеря интереса к жизни.
- Извращение аппетита, например, отвращение от некоторых продуктов (чаще всего это мясо и рыба).
- Явления «желудочного дискомфорта» — чувство тяжести или переполнения желудка, отрыжка, отсутствие физиологического удовлетворения от приема пищи.
- Болезненность в эпигастрии или под грудью.

При распространенных формах инфильтративного рака желудка клиническая картина более типична и развернута:
- Желудочные боли. У 70% больных боль присутствует постоянно, либо возникает без видимых причин, усиливается после приема пищи.
- Анорексия — потеря аппетита.
- Резкое снижение веса.
- Явления анемии — бледность и пастозность кожных покровов.
- Насыщение от приема малого объема пищи. Частый симптом при диффузном раке, поскольку он нарушает способность стенки желудка к растяжению.
- Тошнота и рвота. Инфильтративная форма рака желудка нарушает моторику органа и препятствует прохождению пищевого комка. Пища скапливается, подвергается гниению и брожению, вызывая тошноту и рвоту. В ряде случаев больные сами ее вызывают, чтобы облегчить тягостные симптомы.
- Повышение аппетита. Это казуистический симптом, который характерен только для инфильтративного рака привратника. Опухоль превращает его в зияющую трубку, через которую пища быстро покидает желудок, и чувство насыщения не наступает.
Формы патологии
- Диффузно-инфильтративный. Эта опухоль распространяется по всей толщине стенки и поражает при этом значительную часть желудка.
- Инфильтративно-язвенный, или изъязвляющийся. Обнаруживается инфильтративная опухоль, которая не имеет выраженных границ. Со временем ее поверхность изъязвляется.
Стадии заболевания
Выделяют 4 стадии инфильтративного рака желудка, в зависимости от того, насколько глубоко проросла опухоль, и дала ли она метастазы.
- 0 стадия — это рак in situ, при котором злокачественные клетки обнаруживаются в слизистом слое стенки желудка, или же имеется тяжелая дисплазия слизистой.
- 1 стадия — опухоль прорастает в слизистый и подслизистый слои желудочной стенки, обнаруживаются метастазы в 1-2 лимфоузла, либо рак распространяется на мышечный слой желудочной стенки, но данных за метастазы нет.
- 2 стадия — опухоль прорастает стенку желудка, достигает его серозной оболочки и может даже прорастать в окружающие желудок ткани. Обнаруживается поражение 7 и более лимфоузлов.
- 3 стадия — опухоль выходит за пределы желудка, поражая висцеральную брюшину, рядом расположенные органы (селезенка, толстый кишечник, печень, диафрагма и др), обнаруживаются метастазы в 10-15 лифмоузлах.
- 4 стадия — обнаруживаются отдаленные метастазы во внутренние органы и лимфоузлы.
Диагностика
К сожалению, ранняя диагностика инфильтративного рака желудка часто бывает затруднена, поскольку опухоль имеет эндофитный рост и при визуальном осмотре слизистой во время эндоскопического обследования никак себя не проявляет.
Для обнаружения опухоли и постановки диагноза применяются следующие методы исследования:
- Фиброгастродуоденоскопия. Позволяет под увеличением осмотреть слизистую оболочку желудка и взять биопсию из подозрительных очагов. Как мы уже говорили, при инфильтративном раке этот метод имеет довольно низкую информативность (около 65%). И наличие опухоли в основном можно заподозрить по косвенным признакам.
- Рентгенография желудка с контрастированием. Инфильтративный рак может визуально не обнаруживаться на слизистой, вместе с тем он поражает стенку желудка, что приводит к уменьшению объема органа, нарушению перистальтики, изменению плотности стенок. Эти изменения будут четко прослеживаться при проведении рентгенографии с контрастированием. Такой метод исследования позволяет обнаружить опухоль приблизительно в 90% случаев, но он абсолютно неэффективен на начальной стадии заболевания.
- УЗИ брюшной полости и забрюшинного пространства. Этот метод позволяет определить степень инвазии рака желудка, его распространение за пределы стенки желудка и обнаружить поражение органов брюшной полости, малого таза и регионарных лимфатических узлов.
После постановки диагноза проводят уточняющее обследование, которое необходимо для уточнения стадии заболевания и выбора оптимальной схемы лечения. С этой целью проводят следующие процедуры:
- Анализы на онкомаркеры РЭА, СА 19-9, СА 72-4. С диагностической точки зрения определение этих маркеров не имеет смысла, поскольку они могут оставаться на нормальном уровне даже на 3 стадии заболевания. Однако при изначальном превышении они могут использоваться в качестве контроля лечения и обнаружения рецидива заболевания.
- КТ и/или МРТ с внутривенным контрастированием. Являются альтернативной УЗИ и применяются для определения стадии рака в экономически развитых странах. Метод позволяет обнаружить метастазы в органах брюшной полости, забрюшинного пространства, малого таза, а также обнаружить изменение лимфоузлов.
- Гинекологический осмотр у женщин и пальцевое ректальное исследование у мужчин. Это обследование позволяет обнаружить метастазы рака желудка в яичники (метастаз Крукенберга), параректальные лимфатические узлы (метастазы Шницлера).
- Рентген грудной полости. Проводится для обнаружения метастазов в легких и легочных лимфоузлах, а также поражения плевры.
Индивидуально, по показаниям, диагностика может дополняться следующими исследованиями:
- Эндосонография — чреспищеводное УЗИ. Проводится во время планирования хирургического удаления рака, когда есть данные за его распространение на пищевод и диафрагму. Это исследование позволит обнаружить верхнюю границу опухоли и спланировать объем операции.
- УЗИ и биопсия шейных, надключичных и подмышечных лимфоузлов — обнаружение метастазов Вирхова и Айриша.
- Колоноскопия.
- ПЭТ-КТ.
- Остеосцинтиграфия.
- Биопсия костного мозга при подозрении на наличие метастазов.
- Диагностическая лапароскопия. Она обязательно проводится при тотальном и субтотальном опухолевом поражении желудка, а также прорастании рака за пределы серозной оболочки желудка.
Способы лечения
Основным методом лечения инфильтративного рака является операция. При распространенных формах новообразования ее дополняют химиотерапией. Если хирургическое вмешательство не показано, проводится только химиотерапия.
Хирургия
При лечении инфильтративной формы рака желудка применяются следующие виды операций:
- Гастрэктомия.
- Субтотальная резекция желудка.
При этом пораженная часть желудка или весь желудок удаляется единым блоком с окружающими тканями, куда входят большой и малый сальник, жировая клетчатка и регионарные лимфоузлы 1-2 порядка. Пересечение органа при инфильтративном раке осуществляется не менее, чем 7 см от определяемого края опухоли. Чтобы подтвердить радикальность операции, удаленный фрагмент немедленно подвергают исследованию на наличие опухолевых клеток в краях отсечения.
При распространении рака на соседние органы, объем операции может увеличиваться и включать резекцию пораженных тканей.
Химиотерапия
Химиотерапия может применяться в рамках комбинированного лечения, совместно с операцией, или как самостоятельный метод лечения при нерезектабельных опухолях.
В рамках комбинированного лечения используются следующие виды химиотерапии:
- Периоперационная. Этот вид лечения подразумевает проведение 3 циклов химиотерапии на протяжении 8-9 недель до операции, потом проводят диагностические исследования, и если отсутствуют признаки нерезектабельности, проводят операцию и 3 цикла химиотерапии после нее. Используются схемы CF — цисплатин фторурацил, и ECF — эпирубицин, цисплатин, фторурацил. Такое лечение позволяет увеличить 5-летнюю безрецидивную выживаемость и в целом продлить жизнь пациентам с распространенной формой рака желудка.
- Адъювантная химиотерапия. Это лечение назначается через 4-6 недель после хирургического вмешательства, если не возникло осложнений. Используется пероральные формы фторпиримидина в течение 12 месяцев или схема XELOX (CAPOX) в течение 6 мес. При положительном статусе опухоли HER-2 лечение может дополняться трастузумабом.
При нерезектабельных формах рака желудка, химиотерапия является основным методом лечения. В качестве первой линии терапии назначаются схемы, включающие препараты платины и фторпиримидины. Трехкомпонентные схемы, которые дополняются доцетакселом, улучшают общую выживаемость, но являются более токсичными. Поэтому их назначают только сохранным пациентам. Если имеются метастазы в кости, могут назначаться бисфосфонаты (золедроновая кислота).
Первая линия химиотерапии проводится на протяжении 18 недель, после этого больного наблюдают до прогрессирования заболевания. Если она произошла в течение 3 месяцев после окончания химиотерапии первой линии, применяют препараты второй линии (таксаны), если после прогрессирования прошло более 6 месяцев, можно опять использовать препараты 1 линии. При положительном HER2 статусе лечение дополняется таргетными препаратами.
У ослабленных пожилых пациентов с сопутствующими заболеваниями назначают щадящее лечение, и при улучшении их состояния переходят на режим XELOX. Тяжелым больным показано симптоматическое лечение.
Лучевая терапия
Лучевая терапия в качестве самостоятельного метода лечения не используется. Некоторое время в США адъювантная химиолучевая терапия была стандартом лечения местнораспространенных форм инфильтративного рака. Но проспективные исследования показали, что такая тактика не улучшает прогноз больных, а лечение является более токсичным, по сравнению с адъювантной химиотерапией. Поэтому в настоящее время такой подход не рекомендован.
Основное применение лучевой терапии — паллиативное лечение для облегчения симптомов болезни. Например, ее используют при наличии метастазов в костях для уменьшения болевого синдрома.
Симптоматическое лечение
Симптоматическому лечению подлежат следующие категории больных:
- При 4 стадии заболевания.
- Больные с местнораспространенными нерезектабельными формами рака.
- Больные с тяжелой сопутствующей патологией, делающей невозможным проведение операции или применение цитостатиков.
Симптоматическая терапия направлена на облегчение состояния пациента и борьбу с осложнениями:
- Устранение кровотечений — часто опухоли желудка осложняются обильными кровотечениями. У больных, при этом, отмечается рвота кровавой гущей или алой кровью, мелена в стуле. Для остановки кровотечения проводятся эндоскопические операции.
- Борьба с опухолевым стенозом — здесь применяются различные технологии, от стентирования до наложения обходных анастомозов и выведения гастростомы ниже места поражения.
- Лечение боли — медикаментозная терапия, регионарная анестезия, лучевая терапия.
- Лечение асцита — внутрибрюшная химиотерапия, лапароцентез, установление дренажа.
Прогноз
Инфильтративный рак является крайне агрессивной формой злокачественного новообразования. Он очень рано дает метастазы, часто диагностируется на поздних стадиях, поэтому прогноз более неблагоприятный, по сравнению с другими формами рака желудка.
Меры профилактики
Методы профилактики инфильтративного рака такие же, как и при других злокачественных новообразованиях желудка:
- Оптимизация питания — исключение переедания, сбалансированное питание с достаточным количеством пищевых волокон и витаминов.
- Отказ от курения и злоупотребления алкоголем.
- Использование индивидуальных средств защиты при работе с производственными вредностями.
- Регулярное адекватное обследование лиц из группы риска.
Источник
