Пласт многослойного плоского эпителия в желудке

Ученым удалось разобраться в механизме возникновения предракового состояния в месте соединения пищевода и желудка — синдрома Барретта. Они смогли детально охарактеризовать эпителий в этой пограничной области и на лабораторных мышах показали, что базальные клетки с определенным набором маркеров могут стать предшественниками ткани, подобной ткани кишечника, которая замещает нормальный эпителий этой области. Клетки со сходными свойствами найдены на границе пищевода и желудка и у человека, поэтому данное исследование должно помочь улучшить методы ранней диагностики и лечения онкологических заболеваний.
Хорошо известно, что чем раньше диагностировать и начать лечить рак, тем легче может быть само лечение и тем выше шансы на выздоровление. Для некоторых типов рака выявлены так называемые предраковые состояния — изменения тканей, которые сами по себе не являются злокачественными, но повышают вероятность развития рака в этих тканях. Такие состояния известны пока для относительно небольшого числа раков. Поэтому, с одной стороны, нужно пытаться расширять список соответствий между злокачественными опухолями и предраковыми состояниями, а с другой стороны — выяснять механизмы возникновения этих состояний, чтобы повышать эффективность профилактики рака.
Один из типов предраковых состояний — метаплазии, при которых происходит замещение клеток одного типа клетками другого (как правило, обратимое). Метаплазии часто возникают на границах между разными типами эпителия и могут в таких случаях порождать карциномы — злокачественные опухоли эпителиальных клеток. Эпителий — это ткань, выстилающая поверхность тела (то есть, грубо говоря, кожа), внутренние полости и слизистые оболочки органов. В российской медицине различают два основных вида эпителия — многослойный плоский эпителий (кожа, слизистые оболочки, пищевод) и однослойный цилиндрический эпителий (желудок, кишечник). Особо выделяют эпителий, выстилающий органы, подвергающиеся сильному растяжению (например, в мочевыводящей системе), так называемый переходный. В западной медицине принята более детальная классификация эпителия (см. Epithelium).
Самая распространенная и активно исследуемая форма метаплазии — пищевод Барретта (синдром Барретта). Это — опасное осложнение рефлюксной болезни — заброса содержимого желудка в пищевод, при котором свойственный в норме пищеводу многослойный плоский эпителий в пограничной области соединения пищевода с желудком замещается цилиндрическим (свойственным желудку) с вкраплениями свойственных кишечнику бокаловидных клеток — «одноклеточных желез», выделяющих увлажняющую слизь (см. рис. 1). Частота встречаемости синдрома при рефлюксе составляет 10%, а в целом по популяции — 1%. За последние 40 лет частота встречаемости пищевода Барретта возросла почти в 8 раз. Он считается предраковым состоянием, так как высоколетальная аденокарцинома нижней части пищевода возникает при нем в 10 раз чаще, чем в нормальном пищеводе.
Хотя с момента описания синдрома Барретта в 1950 году он активно изучался, ключевые процессы его развития оставались неизвестными: как возникает замещение плоского эпителия на цилиндрический (метаплазия)? от каких клеток происходит вновь формирующийся цилиндрический эпителий пищевода? как идет последующая трансформация в злокачественные новообразования?
Для объяснения метаплазии было предложено пять основных теорий (они схематично показаны на рис. 2):
1) возможна прямая конверсия плоского эпителия в цилиндрический — повреждение может вызвать превращение одного типа ткани в другой (рис. 2, a);
2) предшественниками цилиндрического эпителия являются циркулирующие в кровотоке стволовые клетки, способные дифференцироваться в цилиндрический эпителий (рис. 2, b);
3) предшественниками цилиндрического эпителия являются клетки субмукозных (слизистых) желез, локализованных под плоским эпителием (рис. 2, c);
4) возможна экспансия в пограничную область клеток цилиндрического эпителия желудка (рис. 2, d);
5) предшественниками цилиндрического эпителия являются остаточные эмбриональные клетки, локализованные вблизи пограничной области (рис. 2, e).

Но ни одна из этих теорий не получила строгого экспериментального подтверждения. И ни одна не объясняла появления вкраплений бокаловидных клеток, свойственных кишечнику (а не пищеводу или желудку).
Большой коллектив ученых из Медицинского центра Колумбийского университета и других научных учреждений США и Китая провел сравнительный анализ экспрессии генов, характерных для эпителия. Они показали, что у мышей пограничный эпителий, состоящий из базальных и люминальных (обращенных в просвет пищевода) клеток, характеризуется различной экспрессией в этих клетках трех маркеров. В базальных клетках экспрессируются два цитокератина — Krt5 и Krt7, а также фактор регуляции транскрипции р63. В клетках люминального слоя экспрессируется только Krt7. Это отличает пограничную область от выше расположенной области пищевода, в которой ни в базальных клетках, ни в плоском эпителии нет экспрессии Krt7 (рис. 1). В эпителии желудка ни один из этих маркеров не экспрессируется.

В следующей серии экспериментов авторы провели тонкую хирургическую операцию на мышах и сделали анастомоз между пищеводом и двенадцатиперстной кишкой (рис. 3). В результате желчные кислоты поступали в пищевод, что позволило имитировать рефлюкс.
Через 18 недель после операции воздействие желчных кислот на пограничную область приводило к формированию клеток «пищевода Барретта», в которых экспрессировался характерный маркер CDX2, и в этой области появлялись бокаловидные клетки. Примечательно, что в расположенной выше части пищевода таких клеток не наблюдалось, несмотря на то что она также подвергалась воздействию желчных кислот.
Ученые решили исключить возможность замещения эпителия в пограничной области пищевода мигрирующими клетками соседних тканей. Для этого с помощью генно-инженерных методов они получили мышей, у которых экспрессия гена Krt7 в клетках эпителия пограничной области была сопряжена с экспрессией красного флюоресцирующего белка Tomato. Эксперименты показали, что в клетках цилиндрического эпителия «пищевода Барретта» экспрессируется Tomato, то есть Krt7. А как уже говорилось, ген Krt7 экспрессируется в эпителии пограничной области, но не экспрессируется в расположенной выше области пищевода и в желудке. Следовательно, клетки цилиндрического эпителия «пищевода Барретта» происходят исключительно от базальных клеток пограничной области (рис. 4).
В заключение авторы решили проверить, насколько похожа структура пограничной области между пищеводом желудком у человека и у мыши. Они провели анализ экспрессии эпителиальных маркеров человек и показали их сходство с мышиными. В этой области у человека были найдены базальные клетки с экспрессией генов p63, KRT5 и KRT7, а также люминальные клетки, в которых экспрессировался KRT7, но не было экспрессии гена p63. В базальных клетках, принадлежащих расположенной выше области пищевода, KRT7 не экспрессировался (рис. 5).

С помощью проточной цитометрии были разделены два типа базальных клеток пищевода человека (с маркерами p63+KRT7− и p63+KRT7+). Из этих клеток in vitro были получены трехмерные культуры органоидов и оказалось, что органоиды, полученные из клеток типа p63+KRT7+ и происходящие из пограничной области пищевода, способны формировать эпителиальные клетки, подобные эпителию кишечника. Органоиды, полученные из клеток типа p63+KRT7−, взятых из выше расположенной области, таким свойством не обладали.
Таким образом, ученым удалось на модели лабораторных мышей охарактеризовать эпителий пограничной области между пищеводом и желудком, который дает начало предраковому состоянию — пищеводу Барретта, а также проверить, что у людей все устроено аналогично. Оказалось, что этот эпителий более чувствителен к повреждающим факторам, чем эпителий расположенных выше областей пищевода или эпителий желудка. Полученные результаты лучше всего согласуются с выдвинутой ранее гипотезой происхождения пищевода Барретта о прямом превращении тканей эпителия пограничной области: показано, что базальные клетки пограничного эпителия могут быть предшественниками эпителия, подобного кишечному, который включает и бокаловидные клетки.
В то же время выявленные в ходе исследования генетические маркеры клеток эпителия пограничной зоны как таковые вряд ли могут быть причиной формирования пищевода Барретта и дальнейшего развития рака. В этом, скорее всего, задействованы какие-то иные факторы — кислотный рефлюкс, другие химические раздражители, гормональные нарушения или вирусные инфекции.
Несмотря на оставшиеся вопросы, обсуждаемая работа дает детальную картину формирования пищевода Барретта. Поскольку предраковые состояния и злокачественные опухоли особенно часто возникают именно в пограничных областях эпителия разных органов (матка, пищевод, прямая кишка), то можно надеяться, что там работают аналогичные механизмы. Впрочем, дальнейшие исследования должны будут прояснить этот вопрос, равно как и то, является ли пограничный эпителий единственным местом возникновения этой метаплазии и дальнейшей трансформации ее в рак. Ведь уже давно было показано, что структура, подобная пищеводу Барретта, может возникнуть и у больных, у которых пограничная область пищевода была удалена (S. R. Hamilton, J. H. Yardley, 1977. Regnerative of cardiac type mucosa and acquisition of Barrett mucosa after esophagogastrostomy). Так что полученные результаты могут способствовать разработке методов диагностики, профилактики и лечения этих состояний не только применительно к пищеводу, но и к другим органам.
Источники:
1) Ming Jiang, Haiyan Li, Yongchun Zhang, Ying Yang, Rong Lu, Kuancan Liu, Sijie Lin, Xiaopeng Lan, Haikun Wang, Han Wu, Jian Zhu, Zhongren Zhou, Jianming Xu, Dong-Kee Lee, Lanjing Zhang, Yuan-Cho Lee, Jingsong Yuan, Julian A. Abrams, Timothy C. Wang, Antonia R. Sepulveda, Qi Wu, Huaiyong Chen, Xin Sun, Junjun She, Xiaoxin Chen & Jianwen Que. Transitional basal cells at the squamous-columnar junction generate Barrett’s oesophagus // Nature. 2017. V. 550. P. 529–533.
2) Lizhe Zhuang & Rebecca C. Fitzgerald. Cancer development: Origins in the oesophagus // Nature. 2017. V. 550. P. 463–464. Синопсис к обсуждаемой статье.
Вячеслав Калинин
Источник
Опухоли пищевода. Доброкачественные и злокачественные опухоли пищевода.К доброкачественным эпителиальным опухолям пищевода относятся плоскоклеточные папилломы, которые встречаются редко, иногда бывают множественными. При гистологическом их исследовании обнаруживаются папилломатозные разрастания многослойного плоского зпителия с нежной соединительнотканной стромой, содержащей небольшое количество тонкостенных сосудов. Из-за редкости этих опухолей трудно судить об их злокачественном потенциале. Имеются лишь единичные сообщения о развитии рака на фоне плоскоклеточной папилломы пищевода. В дистальном отделе пищевода изредка наблюдают аденому, имеющую такое же строение, что и аденомы желудка. Она может развиваться из слизистой оболочки при так называемом пищеводе Баррета, когда в результате хронического рефлюкс-эзофагита и гегеротопяи (что менее вероятно) многослойный плоский эпителий нижней части пищевода замещается цилиндрическим эпителием с формированием структур, соответствующих слизистой оболочке фундального или кардиального отделов желудка, нередко с явлениями кишечной метаплазии. Рак — наиболее часто встречающаяся злокачественная опухоль пищевода. Чаще наблюдают у мужчин? возраст большинства которых 50—70 лет. К предрасполагающим факторам относятся особенности питания — употребление очень горячей и грубой пищи; недостаток витаминов, особенно В2, А; железа, меди, цинка; вредные привычки (курение, алкоголь и др.); некоторые географические особенности местности; аномалии и посттравматические рубцовые изменения пищевода, грыжа пищеводного отверстия диафрагмы, тилоз (гиперкератоз ладоней и подошв), синдром Пламмера—Винсона (железодефицитная анемия, гипохлоргидрия, дисфагия), наблюдающийся преимущественно у жительниц стран Скандинавского полуострова в возрасте 40 -45 лет и др. Заболеваемость раком пищевода колеблется в очень широких пределах, достигая наиболее высоких показателей в некоторых районах Ирана, Китая, Туркменской, Казахской, Узбекской ССР и др. Эпидемиологические исследования показали, что в этих районах среди населения чрезвычайно широко распространен хронический эзофагит (60—80% населения и более), который, очевидно, имеет значение в развитии рака пищевода. При гистологическом исследовании на фоне хронического эзофагита обнаруживают очаговые и диффузные атрофические и гиперпластические изменения многослойного плоского эпителия, пролиферацию базальных клеток, очаги дисплазии, внутриэпителиальный и ранний инвазивный рак.
Такие же изменения часто можно обнаружить при раке пищевода, исследуя слизистую оболочку на различном расстоянии от опухоли. Эти изменения, по-видимому, являются основными этапами морфогенеза рака пищевода, что подтверждается динамическими наблюдениями, проведенными в районах Китая с повышенной заболеваемостью раком пищевода. Предраковые изменения в многослойном плоском эпителии пищевода принципиально не отличаются от аналогичных изменений в шейке матки. Гистологическими критериями дисплазии являются усиление пролиферации и нарушение дифференцировки клеток. Количество базальных клеток, которые в норме занимают не более 15% толщины эпителиального пласта, при дисплазии увеличивается, клетки становятся более крупными, полиморфными, увеличивается число митозов. В зависимости от выраженности клеточных изменений и степени их распространения в эпителиальном пласте различают слабую» умеренную и тяжелую дисплазию. Выраженные полиморфизм и атипия клеток, большое количество митозов, утрата полярности расположения клеток и деления на слои при сохранении базальной мембраны характерны для внутриэпителиального рака. В тех случаях, когда базальная мембрана не прослеживается, имеется тенденция к погружному росту и отшнуровка эпителиальных комплексов, изменения должны расцениваться как начало инвазивного рака. При гистологическом исследовании, особенно по материалу эндоскопической биопсии, бывает трудно дифференцировать диспластические (предраковые) изменения и реактивную гиперплазию базальных клеток, которая может наблюдаться, например, при рефлюкс-эзофагите. Трудности возникают также при дифференциальной диагностике тяжелой дисплазии, карциномы in situ и инвазивного рака. Для уточнения характера процесса необходимы динамическое наблюдение за такими больными и повторные биопсии. Основная масса форм плоскоклеточного рака пищевода, видимо, развивается из покровного эпителия. Другим источником развития рака пищевода могут быть слизистые железы, в которых при хроническом гастрите также наблюдают атрофические и гиперпластические изменения, образование кист, пролиферацию резервных клеток, плоскоклеточную метаплазию и дисплазию эпителия. Из них могут возникать плоскоклеточный рак, аденокарцинома, железисто-плоскоклеточный рак, а также мукоэлидермоидная опухоль и аденокистозный рак (цилиндрома), аналогичные соответствующим опухолям слюнных желез. Аденокарциномы в пищеводе могут развиваться также от остатков цилиндрического эпителия, выстилающего пищевод на ранних стадиях эмбриогенеза, участков гетеротопии слизистой оболочки желудка. Аденокарциномы дистальной части пищевода могут развиваться также на фоне так называемого пищевода Баррета. Во многих случаях труден или невозможен дифференциальный диагноз такой аденокарциномы и рака кардиального отдела желудка, прорастающего в пищевод. Рак пищевода наиболее часто локализуется в средней его трети, затем следует нижняя треть пищевода; верхняя его треть поражается редко. Исключение составляет рак пищевода при синдроме Пламмера—Винсона, который наблюдается преимущественно у женщин 40—45 лет и поражает самый верхний отрезок пищевода. Макроскопически большинство форм рака пищевода представляет собой изъязвленные блюдцеобразные или эндофитные опухоли, часто циркулярно охватывающие стенку, нередко на значительном протяжении. Экзофитные опухоли встречаются редко. Рак пищевода может распространяться по подслизистому слою далеко за пределы видимого очага опухоли, а также прорастать в прилежащие к пищеводу ткани и органы. Для суждения о степени распространенности процесса и радикальности оперативного вмешательства при исследовании удаленного отрезка пищевода необходимо изучение линий операционных разрезов и глубины прорастания стенки пищевода. – Также рекомендуем “Плоскоклеточный рак пищевода. Признаки плоскоклеточного рака пищевода.” Оглавление темы “Опухоли пищевода и желудка.”: |
Источник
Эпителий слизистой желудка. Клетки желудка.
Клетки покровного эпителия и желез желудка имеют единое происхождение — стволовая (исходная, недифференцированная) клетка. Эти клетки располагаются в перешейке и шейке желез и участвуют:
– в обновлении покровного эпителия с высокой скоростью — полное обновление в течение 3—4 суток;
– в образовании всех типов клеток собственных желез — скорость обновления зависит от типа клеток и составляет недели/месяцы.
В цитоплазме клеток содержится достаточно большое количество кислых мукополисахаридов, которые обеспечивают собственную защиту клеток от самопереваривания.
В процессе дифференцировки образуются:
– покровные эпителиоциты;
– железистые эпителиоциты:
– экзокриноциты — шеечные и добавочные мукоциты (синтезируют слизь), главные клетки (вырабатывают ферменты), париетальные клетки (участвуют в образовании соляной кислоты) и т.д.; > эндокриноциты — энтерохромофинные клетки (ЕС), энтерохромофиноподобные клетки (ECKL), G-клетки, D-клетки, I-клетки, Н-клетки, Р-клетки и др. Покровные эпителиоциты локализованы на внутренней поверхности желудочной стенки и являются составной частью покровного эпителия, который относится к однослойному, призматическому, железистому. Основная функция клеток — синтез и секреция —
– слизи и
– простагландинов.
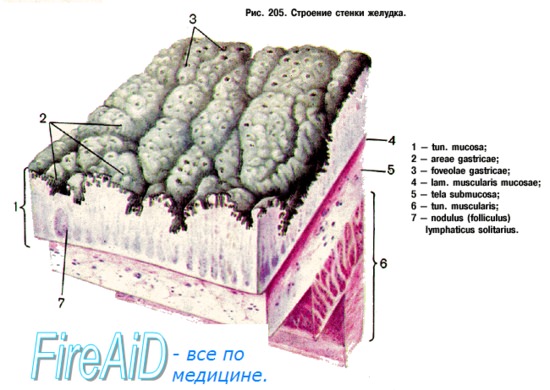
Слизь — это важная часть системы защиты эпителия от повреждений, обладающая бактерицидными и буферными свойствами.
Простагландины — соединения, образующиеся во многих органах и тканях, и в настоящее время их относят к гормонам. Основные свойства этих соединений обеспечивают их цитопротективный эффект в желудке —
– стимуляция образования слизи;
– активация секреции бикарбонатов, нейтрализующих соляную кислоту;
– улучшение микроциркуляции в слизистой;
– ингибирование секреции соляной кислоты;
– угнетение образование гастрина;
– активация регенерации клеток (повышение содержания ДНК в пораженных -клетках слизистой желудка);
– повышение устойчивости клеточной мембраны (ингибирование обратной диффузии ионов водорода).
В желудке секреция простагландинов повышается в ответ на увеличение концентрации соляной кислоты. Это в свою очередь приводит к повышению выделения слизи и бикарбонатов. Последовательность высвобождения биологически активных соединений следующая: стимуляция секреции соляной кислоты => секреция простагландинов => секреция слизи.
Экзокриноциты. На рисунке 14 представлена принципиальная схема строения клеток, которые представляют группу экзинокритов.
Шеечные и добавочные мукоциты локализуются в шейке и теле желез и являются низкопризматическими. При окраске цитоплазма — слабоокрашенна.
Добавочные мукоциты являются основными клетками кардиальных и пилорических желез желудка, а также присутствуют в главных железах дна и тела желудка.
В главных железах мукоидные клетки выстилают начальные отделы шеек желез.
Главные экзокриноциты располагаются группами в главных железах в области тела и дна (в большей степени), имеют пирамидальную форму и базофильную окраски. При изучении с помощью электронной микроскопии в клетках выявляется выраженная гранулярная эндоплазматическая сеть (ЗПС), пластинчатый комплекс и значительное количество митохондрии, а на апикальной поверхности определяются микроворсинки. В них синтезируются проферменты желудочного сока (пепсиноген, химозин, липаза).
Париетальные клетки локализуются в теле и на дне главных желез, располагаются поодиночке и имеют неправильную округлую (грушевидную) форму. Широкая округлая базальная часть клетки располагается как бы вторым слоем — кнаружи по отношению к главным экзокриноцитам, поэтому они и получили название париетальные, а их апикальная часть в виде узкой шейки достигает просвета железы. При окраске их цитоплазма оксифильна (ацидофильна), зерниста и в ней определяется большое количество митохондрий. При электронном микроскопировании в цитоплазме видна система сильно разветвленных внутриклеточных канальцев и много митохондрий. В париетальных клетках образуются соляная кислота, большая часть воды желудочного сока и антианемический фактор Кастла.
Подводя итог, отметим еще раз, в каких экзинокритах синтезируются основные ингредиенты желудочного сока — мукоциты — слизь главные экзокриноциты — проферменты желудочного сока, париетальные клетки — соляная кислота, большая часть воды и антианемический (внутренний) фактор Кастла.
– Также рекомендуем “Эндокриноциты желудка. Железы желудка.”
Оглавление темы “Строение и функции желудка.”:
1. Желудочно-кишечный тракт. Ротовая полость.
2. Желудок. Функции и строение желудка. Ферменты желудка.
3. Двенадцатиперстная кишка. Строение, функции и ферменты двенадцатиперстной кишки.
4. Пищеварение в тонкой кишке. Функции тонкой кишки.
5. Толстый кишечник. Строение и функции толстого кишечника.
6. Формы желудка. Отделы желудка.
7. Особенности слизистой желудка. Пищеварительный лейкопидез.
8. Эпителий слизистой желудка. Клетки желудка.
9. Эндокриноциты желудка. Железы желудка.
10. Нервная регуляция желудка. Роль нервной системы в регуляции желудка.
Источник

