Пептидаза которая синтезируется в желудке
3) Покажите схематично путь синтеза жирных кислот
49) Жиры являются наиболее энергоемкими молекулами. Объясните это, исходя из структуры жиров, и рассчитайте количество молекул АТФ, образующихся при окислении одной молекулы трипальмитина.
1) Напишите реакцию гидролиза этого соединения
2) Рассчитайте число молекул АТФ, образующихся при окислении одной молекулы пальмитиновой кислоты
С15Н31СООН→8АУК+7НАДФН2+7ФПН2=130АТФ(-1 активация)
↓ ↓ ↓
ЦТК БО БО
↓ ↓ ↓
БО ОФ ОФ
↓ ↓ ↓
ОФ 21 АТФ 14 АТФ
↓
96 АТФ
3) Напишите схему окисления глицерина и укажите количество АТФ, образуемое при этом процессе. Рассчитайет суммарный выход АТФ при окислении одной молекулы трипальмитина.
Глицерин→(цитоплазма)→ПВК+2АТФ+2НАДН2=23АТФИЛИ21АТФ
(митохондрии)↓ ↓ ↓
НАДН2+АУК+СО23малатный или 2глицерофосфатный
↓ ↓ ↓ ↓
БО ЦТК 6АТФ 4АТФ
↓ ↓
ОФ БО
↓ ↓
3АТФ ОФ
↓
12 АТФ
Суммарный выход АТФ при окислении 1 молекулы трипальмитина = 410 АТФ или 412 АТФ
50) При одном из наследственных заболеваний в скелетных мышцах больных снижена концентрация карнитина в результате дефекта ферментов, участвующих в его синтезе. Почему у таких больных снижена способность выполнять физическую работу?
1) Напишите схему, показывающую роль карнитина в метаболизме жирных кислот
2) Укажите, скорость какого метаболического пути снижена у таких больных
3) Объясните, почему в клетках мышц больных содержатся большие вакуоли жира, видимые под микроскопом
1) ПЕРЕНОСЧИКОМ АКТИВИРОВАННЫХ ЖИРНЫХ КИСЛОТ С ДЛИННОЙ ЦЕПЬЮ ЧЕРЕЗ ВНУТРЕННЮЮ МИТОХОНДРИАЛЬНУЮ МЕМБРАНУ СЛУЖИТ КАРНИТИН.
Все ферменты Б-окисления жирных кислот находятся в митохондриях . Внутренняя мембрана непроницаема для жирных кислот. Перенос их происходит при помощи картнитина.
(СН3)3N+-CH2-CH2-CHOH-CH2-COOH
При деиствии карнитин-ацилтрансферазы 1 к спиртовой группе карнитина присоединяется жирная кислота.
Ацил-SКоА + Карнитин = Ацилкарнитин + НSКоА
2) При отутствии ферментов, участвующих в синтезе карнитина будет снижено Б-окисление СЖК. Так как далее все процессы происходят в митохондриях при отсутствии карнитина активированная жирная кислота не проникнет во внутреннюю мембрану митохондрии. В клетках накапливается большое количество СЖК, которые не подверглись окислению. Больные не могут выполнять физическую работу так как не выделяется АТФ ,которая могла бы образовываться при Б-окислении СЖК.
3) Длинноцепочечные ацил-CoA-производные (или СЖК ) не могут проникать в митохондрии и окисляться, если предварительно не образуют ацилкарнитин-производных. А вследствие недостатка карнитина этот процесс переноса СЖК в митохондрии тормозится и СЖК скапливается в виде вакуолей жира в цитоплазме.
51)Экспериментальные животные в течение 1 недели получали с пищей избыток глюкозы, содержащей радиоактивный углерод. Затем животные голодали в течение 2 дней. В крови обнаружены кетоновые тела, содержащие радиоактивный углерод. Объясните результаты экспериментов.
1) Напишите схему катаболизма глюкозы до ацетилКоА
2) Покажите схему использования ацетилКоА в синтезе кетоновых тел
3) Назовите ключевые ферменты катаболизма глюкозы и синтеза кетоновых тел
1)
2) 3) альтернативный источник
52) У двух мужчин 60 лет определили уровень общего холестерола и индекса ЛПНП/ЛПВП. У обоих пациентов общий холестерол – 6,0мМ/л, но ЛПНП/ЛПВП (Липопротеиды низкой плотности)/( Липоротеиды высокий плотности) индекс у первого пациента был равен 4, а второго 3,1. Оцените полученные данные.
1) Определите у кого из пациентов выше риск атеросклероза и его осложнений
2) Составьте схему, показывающую роль ЛПВП в транспорте холестерина
3) Объясните, почему ЛПНП называют атерогенными липопротеинами, а ЛПВП – антиатерогенными
1) ЛПНП/ЛПВП (коэф. атерогенности) при его значении >3 имеется риск развития атеросклероза и т.к. у первого пациента он равен 4, то следовательно у него выше риск.
2) ЛПВП транспортируют холестерин в виде эфиров холестерина из тканей в печень. В образовании из холестерина эфиров холестерина в ЛПВП большую роль играет фермент ЛХАТ (лецитинхолестеролацилтрансфераза), который катализирует реакцию:
Холестерин + лецитин = холестерид + лизолецитин
Эта реакция идет в гидрофильном слое ЛПВП, а образовавшиеся хлестериды переходят в гидрофобное ядро.
3) ЛПВП транспортируют холестерин в виде эфиров холестерина из тканей в печень, тем самым снижая риск развития атеросклероза. ЛПНП транспортируют холестерин из печени в другие ткани, тем самым повышая риск развития атеросклероза.
53) У больного развился острый панкреатит, при этом стенки протока поджелудочной железы воспалились и отекли, просвет протока уменьшился, наблюдаются застойные явления. Таким больным необходима срочная медицинская помощь. Объясните, чем опасно затруднение оттока сока поджелудочной железы.
1) Назовите ферменты, которые синтезируются в поджелудочной железе
2) Укажите пути их активации, назовите активаторы проферментов
3) Объясните, к каким последствиям приведет их активация в ткани поджелудочной железы
1) Липаза, трипсин, химотрипсин, карбоксипептидазы А и В, фосфолипазы А и В, эластаза, амилаза
2) Панкреатическая липаза выводится в двенадцатиперстную кишку в виде неактивного профермента – пролипазы. Активация пролипазы в активную липазу происходит под действием жёлчных кислот и другого фермента сока поджелудочной железы – колипазы.
Трипсиноген превращается в трипсин в полости двенадцатиперстной кишки под влиянием фермента энтерокиназы, который вырабатывается слизистой оболочкой кишки. Выделение энторокинизы обусловлено влиянием желчных кислот. С появлением трипсина наступает аутокаталитический процесс активации всех протеолитических ферментов, выделяющихся в зимогенной форме.
Химотрипсиноген и предшественник карбоксипептидазы сока поджелудочной железы активируются трипсином, но не энтерокипазой. Следовательно, эта активация происходит только в кишечнике, где присутствует трипсин.
Фосфолипазы также активируются трипсином.
Эластаза активируется в просвете кишечника трипсином из проэластазы.
Альфа- амилаза является кальций-зависимым ферментом, так как ее деятельность активируется ионом кальция.
3) Бурно и быстро развивающееся воспаление поджелудочной железы, которая начинает атаковаться собственными ферментами, стремящимися к самоперевариванию. Рычагом к воспалительному процессу служит преждевременная активация ферментов железы. Участвуют в этом процессе активные ферменты – липаза и фосфолипаза А. Фосфолипаза действует на клеточную мембрану, разрушая ее и впуская тем самым липазу в клетку, что приводит к разрушению поврежденной клетки. Эти процессы, в конечном итоге, способствуют к появлению так называемых панкреатических атак и изменениям в самих тканях железы и вокруг их. Они способствуют отеку ткани и даже деструктивным последствиям – панкреонекрозу.
54) В желудочном соке больного обнаружен высокий уровень лактата и желчные пигменты. Укажите, какие заболевания желудка возможны в этом случае.
1) Назовите процесс, продуктом которого является лактат, почему лакатат накапливается в желудке и с помощью какой качественной реакции можно определить его наличие?
2) Укажите роль соляной кислоты, виды и нормальное значение кислотности желудочного сока
3) Почему в желудке появляются желчные пигменты, качественная реакция на них
1) Лактат образуется при анаэробном гликолизе.
Лактат обнаруживается в желудочном соке при раке желудка, сопровождающемся ахлоргидрией и задержкой эвакуации пищи. У таких больных желудочное содержимое носит застойный характер, отмечается брожение углеводов с образованием молочной кислоты.
Реакция УФЕЛЬМАНА! Метод основан на способности молочной кислот в присутствии фенолята железа (III) образовывать малодисоциирующую соль лактата железа желто-зеленого цвета.
2) Роль СОЛЯНОЙ КИСЛОТЫ:
– в желудке под ее влиянием происходит набухание белков, увеличивается их поверхность, что облегчает воздействие на них ферментов желудочного сока
– под ее действием из профермента пепсиногена образуется активный фермент пепсин. Прогастриксин активируется пепсином.
– она обладает бактерицидным действием
– она способствует эвакуации пищи из желудка, регулируя функцию привратника.
– она стимулирует деятельность поджелудочной железы
Виды КИСЛОТНОСТИ желудочного сока:
1. Общая кисл-ть – это сумма всех кислореагирующих в-тв (своб. и связанная HCl, орган.к-ты, кислые фосфаты) – в 100 мл желудочного сока. НОРМА = 40-60 ТЕ (титрационных единиц)
2. Свободная HCl НОРМА = 20-40 ТЕ
3. Связанная HCl (с белками). НОРМА = 8-12 ТЕ
3) Желчные пигменты вместе с желчью появляются в желудке при понижено кислотности или при полном отсутствии кислоты. В этом случае нарушается функция привратника, он расслаблен, и кишечное содержимое может забрасываться в желудок. Этому также может способствовать и неплотное закрытие привратника в связи с рубцовыми процессами в нем.
В результате за счет желчных пигментов: при наличии HCl в желудочном соке, его окраска будет зеленоватой т.к. билирубин окисляется в биливердин. При отсутствии HCl окраска желудочного сока будет желтой.
Реакция ПЕТТЕНКОФЕРА на желчные кислосты! Под влиянием серной кислоты сахароза гидролизуется с последующим превращением моносахаридов в оксиметилфурфурал. Конденсация желчных кислот с оксиметилфурфуралом приводит к образованию веществ красного цвета.
55) У больного язвенной болезнью желудка провели операцию с удалением части желудка. Но послеоперационное обследование показало, что процесс переваривания белков у пациента существенно не изменился. Объясните полученные результаты обследования.
1) Назовите пептидазу, которая синтезируется в желудке, механизм ее активации и активаторы
2) Перечислите панкреатические пептидазы и ферменты энтероцитов (клеток кишечника)
3) Назовите, к какой группе пептидаз относятся данные ферменты
1) Эндопептидазы пепсин и гастриксисин, гидролизуют белки до полипептидов в присутствии HCl.
Под действием НСl пепсиноген превращается в активный пепсин с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ).
Профермент гастриксина прогастриксин секретируется железами желудка и активируется, также как и профермент пепсина – пепсиноген, соляной кислотой желудочного сока. Гастриксин, в отличие от пепсина, протеолетически активен в менее кислой среде. Гастриксин является вторым по объёму после пепсина среди содержащихся в желудочном соке протеолитических ферментов. Количество гастриксина в желудочном соке здорового взрослого человека составляет 20–50 % от количества пепсина. Гастриксин вместе с пепсином обеспечивают до 95 % всей протеолитической активности желудочного сока.
2) и 3) Эндопептидазы (под их действием белки распадаются до полипептидов) поджелудочной железа: трипсин, химотрипсин, эластаза
Экзопептидазы (под их действием белки разрушаются до отдельных аминокислот) поджелудочной железы: карбоксипептидазы
Экзопептидазы кишечного сока: аминопептидазы, ди- и трипептидазы
56) Здоровых крыс длительное время содержали на искусственном белковом рационе, исключающем аминокислоты лейцин, валин и фенилаланин. Как изменится у этих животных азотистый баланс? Ответ поясните.
1) Дайте определение азотистого баланса
2) К какой группе аминокислот по возможности синтеза в организме относятся эти аминокислоты
3) Назовите возможные причины отрицательного и положительного азотистого баланса
1) Азотистый баланс – это соотношение количества поступившего азота к количеству азота, экскретируемого с мочой и фекалиями.
2) Лейцин, валин, фенилаланин (+ изолейцин, треонин, лизин, метионин, триптофан=8) относятся к незаменимым аминокислотам. Т.е. они не синтезируются в организме человека, а поступают только с пищей.
3) Положительный азот.баланс наблюдается, когда азота белков пищи больше чем кол-во экскретируемого азота. Наблюдается в растущем организме, при беременности.
Отрицательный азот.баланс возникает, если азота пищи меньше азота мочи и кала. Наблюдается у пожилых людей, грудных детей при недостаточном поступлении белков, при распаде опухоли, голодании, травмах, ожогах, при нарушении их усвоения, усиленном распаде собственных белков.
57) У пациента с подозрением на инфаркт миокарда определяли активность АЛТ (аланинаминотрансферазы) и АСТ (аспартатаминотрансферазы) в крови.
a) Активность какой из аминотрансфераз увеличится в большей степени при такой патологии и почему? – АСТ (аспартатаминотрансферазы) органотропный фермент миокарда.
в) Назовите другие ферменты, активность которых определяют в крови для подтверждения указанной патологии – ЛДГ1 ЛДГ2. ?
1) Напишите реакции, которые катализируют АЛТ и АСТ
2) Объясните значение этих реакций в метаболизме аминокислот
Переаминирование – это обратимый процесс переноса аминогруппы с аминокислоты на кетокислоту с образованием заменимой аминокислоты. Чаще всего источником аминогруппы служит глутаминовая кислота. Ферментом, катализирующим этот процесс, являются аминотрансферазы (трансаминазы), коферментом которых является витамин пиридоксальфосфат (В6).
AЛT и ACT – это органоспецифичные ферменты. В клинике определение активности АЛТ используется для диагностики заболеваний печени (гепатиты, желтухи), активности ACT – при патологии миокарда (инфаркт миокарда).
Значение переаминирования:
1) образование заменимых аминокислот
2) реакция является первой стадией непрямого окислительного дезаминирования аминокислот
3) так как реакция обратима, возможна взаимосвязь между обменом углеводов и обменом белков.
3) Объясните принципы энзимодиагностики
Энзимодиагностика заключается в постановке диагноза заболевания на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
· при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
· количество высвобождаемого фермента достаточно для его обнаружения;
· активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений;
· ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
· существуют различия во внутриклеточной локализации ряда ферментов
58) При обследовании пациента оказалось, что концентрация креатинина в моче составляет 30мМ/л (при норме 88-176мМ/л).
Поражение какого органа можно предположить? Почки Печень
1) Перечислите аминокислоты – предшественники креатинина
2) Напишите схему образования креатинина и укажите органы, которые участвуют в этом процессе
Источник
единица | 9.1. Роль 9.2. Переваривание 9.3. Трансаминирование |
Модульная | 9.4. Обмен 9.5. Орнитиновый 9.6. Гипераммониемия 9.7. Пути 9.8. Биосинтез |
Модульная | 9.9. Обмен 9.10. Обмен 9.11. Обмен 9.12. Заболевания, 9.13. Биогенные |
ЕМА 9.1. РОЛЬ
БЕЛКОВ В ПИТАНИИ. АЗОТИСТЫЙ БАЛАНС
В организме
человека содержится примерно 15 кг
белков. Количество свободных аминокислот
составляет около 35 г. Ежесуточно в
организме распадается до аминокислот
почти 400 г белков и столько же синтезируется.
1. Основным
источником аминокислот для человека
являются пищевые белки. Суточная норма
потребления белков составляет в среднем
около 100 г.
20 α-аминокислот,
которые встречаются в белках организма,
можно разделить на четыре группы:
• заменимые
аминокислоты – Ала, Асп, Асн, Глу, Глн,
Про, Гли, Сер –
синтезируются в необходимых количествах
в организме;
• незаменимые
аминокислоты – Вал, Лей, Иле, Мет, Фен,
Три, Лиз, Тре –
не могут синтезироваться в организме
и должны поступать с пищей;
• частично
заменимые аминокислоты – Гис, Арг –
синтезируются очень медленно, в
количествах, не покрывающих потребности
организма, особенно в детском возрасте;
• условно
заменимые аминокислоты – Цис, Тир –
синтезируются из незаменимых аминокислот
Мет и Фен соответственно.
2. Полноценность
белкового питания зависит
от аминокислотного состава белков и
определяется наличием незаменимых
аминокислот.Отсутствие
в пищевых белках незаменимых аминокислот
(даже одной) нарушает их синтез в
организме. Обновление белков в различных
тканях происходит с разной скоростью.
Так, белок соединительной ткани коллаген
обновляется полностью за 300 дней, а
белки системы свертывания крови – от
нескольких минут до нескольких дней.
3. Большая
часть свободных аминокислот используется
для синтеза собственных белков организма.
Кроме того, из аминокислот синтезируется
большое количество биологически
активных молекул:
• биогенные
амины (медиаторы); некоторые аминокислоты
сами являются нейромедиаторами –
например, глицин и глутамат;
• гормоны
белковой природы;
• гем,
креатин, карнитин и другие азотсодержащие
соединения.
Аминокислоты
подвергаются реакции дезаминирования;
образовавшиеся безазотистые остатки
используются для синтеза глюкозы,
кетоновых тел или окисляются до СО2 и
Н2О.
Азот аминокислот
выводится из организма почками в виде
мочевины или аммонийных солей.
Аминокислоты и белки содержат до 95%
всего азота организма.
4. Азотистый
баланс –
разница между количеством азота,
поступающего с пищей, и количеством
азота, выделяемого почками в виде
мочевины и азотистых солей. Он является
показателем состояния белкового и
аминокислотного обмена.
Азотистый
баланс может
быть:
• положительным –
у детей, беременных женщин, при увеличении
мышечной массы у спортсменов и больных,
выздоравливающих после тяжелой болезни,
что свидетельствует о преобладании
синтеза белков и роста тканей над их
распадом;
• отрицательным –
при тяжелых заболеваниях, голодании,
старении, что свидетельствует об
усилении процессов распада белков;
• равным
нулю (азотистое равновесие) – у
здоровых взрослых людей при нормальном
питании.
1. При
переваривании происходит гидролиз
пищевых белков до свободных аминокислот.
Процесс переваривания начинается в
желудке и продолжается в тонком кишечнике
под действием ферментов пептидгидролаз
(пептидаз). Основные
пептидазы синтезируются в клетках
желудка, поджелудочной железы и кишечника
(рис. 9.1). В желудке белки
пищи денатурируются и гидролизуются
с образованием олигопептидов.
Вкишечнике панкреатические
пептидазы продолжают гидролиз
олигопептидов до ди- и трипептидов и
свободных аминокислот. Короткие пептиды
расщепляются до свободных аминокислот
в пристеночном
слое или
в клетках кишечного эпителия. Затем
происходит их всасывание.
Все пептидазы, в
зависимости от места расположения в
пептиде гидролизуемой связи, делятся
на
эндопептидазы и экзопептидазы:
• эндопептидазы –
расщепляют пептидные связи, удаленные
от концов пептидной цепи (пепсин,
трипсин, химотрипсин, эластаза);
• экзопептидазы
– гидролизуют
пептидные связи, образованные N- и
С-концевыми аминокислотами (аминопептидаза,
карбоксипептидазы А и В),
а также расщепляют ди- и трипептиды.
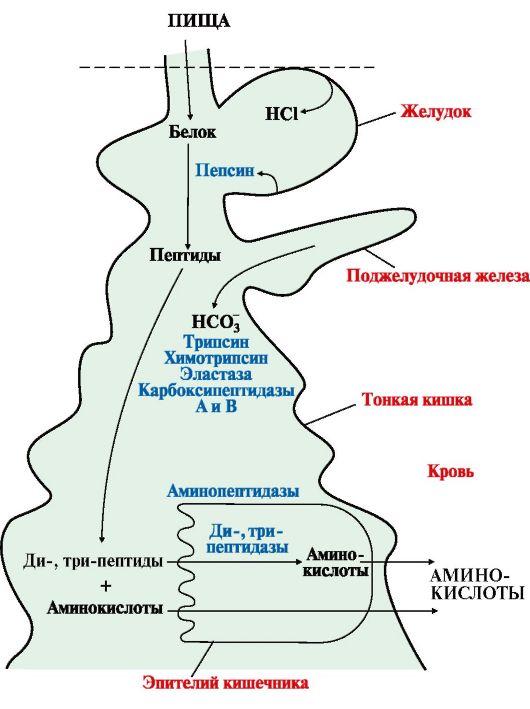 Рис.
Рис.
9.1. Переваривание белков в желудочно-кишечном
тракте
Ферменты,
участвующие в переваривании белков,
обладают относительной субстратной
специфичностью и гидролизуют пептидные
связи; при этом каждая пептидаза
преимущественно расщепляет связи,
образованные определенными аминокислотами
(табл. 9.1).
2. Желудочные
и панкреатические пептидазы вырабатываются
в неактивной форме (проферменты), секретируются
к месту действия, где активируются путем
частичного протеолиза (отщепление
пептида различной длины, чаще с N-конца
молекулы профермента). Место
синтеза проферментов (клетки
слизистой оболочки желудка, поджелудочная
железа) и место
их активации (полость
желудка, тонкого кишечника)пространственно
разделены. Такой
механизм образования активных ферментов
необходим для защиты секреторных клеток
желудка и поджелудочной железы от
самопереваривания.
Таблица
9.1. Характеристика протеолитических
ферментов желудочно-кишечного тракта
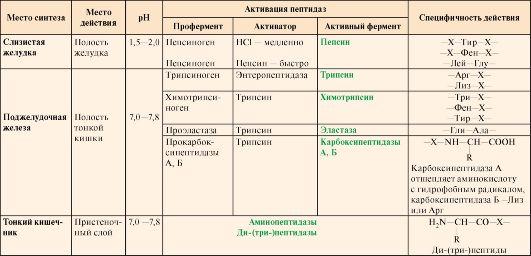 Примечание: X
Примечание: X
– любая аминокислота
Преждевременная
активация проферментов в секреторных
клетках происходит при:
• язвенной
болезни желудка –
пепсиноген превращается в пепсин в
клетках слизистой желудка;
• остром
панкреатите –
трипсиноген превращается в трипсин в
клетках поджелудочной железы и активирует
остальные панкреатические пептидазы.
3. Слизистая
оболочка желудка вырабатывает следующие
факторы, необходимые для переваривания
белков:
• пепсиноген –
синтезируется в главных клетках;
• соляную
кислоту –
вырабатывается обкладочными клетками.
Гидролиз белков в
желудке происходит
под действием пепсина.
Профермент
пепсиноген при поступлении пищи
секретируется в полость желудка, где
в два этапа происходит его активация:
• с помощью
НС! – медленно;
• аутокаталитически
– быстро, уже имеющимся пепсином. Соляная
кислота желудочного
сока выполняет следующие функции:
• .участвует
в активации пепсиногена;
• создает
оптимум рН для пепсина;
• оказывает
бактерицидное действие;
• денатурирует
белки пищи.
Значение рН
желудочного сока в норме составляет
1,5-2,0. Определение
кислотности желудочного сока используется
для диагностики различных заболеваний
желудка (табл. 9.2).
Таблица
9.2. Компоненты желудочного сока в норме
и при патологических состояниях
• 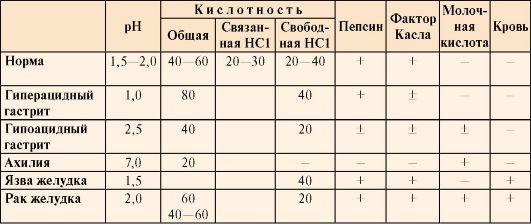 Общая
Общая
кислотность желудочного сока –
это совокупность всех кислотореагирующих
веществ желудочного сока, представляющая
собой секрет желудка, собираемый в
течение 1 часа (предварительно отбирают
секрет, ранее содержащийся в желудке).
• Связанная
соляная кислота –
это соляная кислота, связанная с белками
и продуктами их переваривания.
• Свободная
соляная кислота –
это соляная кислота, не связанная с
другими молекулами.
• Общая
кислотность желудочного сока выражается
в титрационных единицах (ТЕ) и
измеряется количеством 0,1 М NaOH в
миллилитрах, затраченным на титрование
100 мл желудочного сока в присутствии
определенных индикаторов.
• Кислотность
желудочного сока в
норме составляет:
общая 40-60 ТЕ;
связанная
HCl 20-30 ТЕ;
свободная
HCl 20-40 ТЕ.
При диагностике
заболеваний желудка помимо биохимических
анализов обязательно проводят
рентгенологические и эндоскопические
исследования, иногда биопсию.
В слизистой
оболочке желудка вырабатывается
также внутренний
фактор (фактор Касла), который
представляет собой белок, способствующий
всасыванию витамина В12 в
тонкой кишке. Отсутствие этого витамина
часто приводит к развитию анемии.
Молочная
кислота в
норме в желудочном соке отсутствует.
Образуется при уменьшении содержания
или отсутствии свободной соляной
кислоты в результате усиленного
размножения молочнокислых бактерий
или при злокачественных опухолях
желудка.
НС1 и пепсин
способны разрушать клетки эпителия
желудка. В норме это не происходит
благодаря наличию защитных факторов
слизистой оболочки, таких, как:
• образование
на поверхности слизи, содержащей
гетерополисахариды, которые не являются
субстратами пептидгидролаз;
• секреция
эпителиальными клетками ионов НСО3-,
создающих в пристеночном слое менее
агрессивную среду с рН 5,0-6,0, в которой
пепсин неактивен. Кроме того, клетки
поврежденного эпителия обладают
способностью к быстрой регенерации.
Пепсин
гидролизует пептидные
связи, образованные аминогруппой или
карбоксильной группой ароматических
аминокислот (см. табл. 9.1):
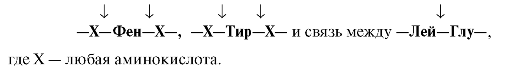 4.
4.
Переваривание белков в кишечнике происходит
под действием:
• ферментов
поджелудочной железы-трипсина,
химотрипсина, эластазы, карбоксипептидаз
А и Б;
• ферментов
эпителия тонкой кишки – аминопептидазы,
дипептидаз, трипептидаз.
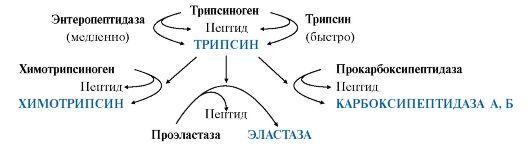
Активная
форма трипсина образуется
в кишечнике при участии фермента
энтеропептидазы, выделяемого клетками
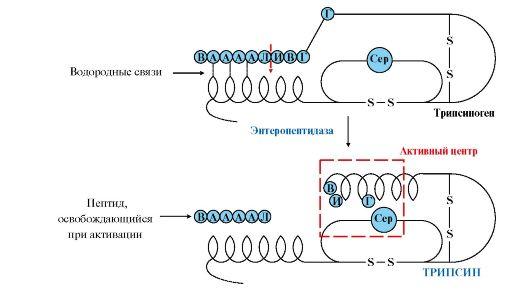
кишечника. Энтеропептидазаотщепляет
от N-конца трипсиногена гексапептид
(рис. 9.2), что приводит к изменению
конформации молекулы и формированию
активного центра трипсина.
 Рис.
Рис.
9.2. Механизм активации трипсиногена.
Пунктирная
стрелка – место гидролиза. Буквами
обозначены аминокислоты (А – асп, Г –
глу, В – вал, Л – лиз, И – иле)
Остальные проферменты
панкреатического сока (химотрипсиноген,
прокарбоксипептидазы А и В, проэластаза)
активируются трипсином.Активация
панкреатических пептидаз в кишечнике
происходит в виде каскада реакций.
 Ферменты
Ферменты
эпителия тонкой кишки синтезируются
в энтероцитах сразу в
активной форме.
• Ферменты,
участвующие в переваривании белков в
кишечнике, обладают
субстратной специфичностью к
определенным аминокислотам в
белке: Трипсин гидролизует
преимущественно пептидные связи,
образованные карбоксильными группами
катионогенных аминокислот:
• 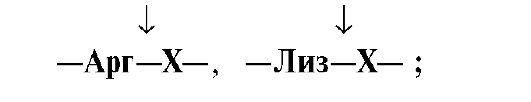 Химотрипсин –
Химотрипсин –
пептидные связи, образованные
карбоксильными группами ароматических
аминокислот:
•  Эластаза –
Эластаза –
связь между -Гли-Ала-
• Карбоксипептидазы отщепляют
С-концевые аминокислоты:
карбоксипептидаза А –
гидрофобные аминокислоты, карбоксипептидаза В
– Лиз и Арг;
• Аминопептидаза –
отщепляет N-концевые аминокислоты;
• Дипептидаза –
гидролизует дипептиды;
• Трипептидаза –
расщепляет трипептиды на отдельные
аминокислоты.
5. Конечным
результатом переваривания белков
является образование свободных
аминокислот, поступающих в клетки
слизистой оболочки кишечника,
путем вторично-активного
транспорта за
счет градиента концентрации натрия
(симпорт). Всасывание L-аминокислот
является активным, требующим затраты
энергии процессом. Транспорт их
осуществляется двумя путями:
• через
воротную систему печени;
• по
лимфатическим сосудам, сообщающимся
с кровью через грудной лимфатический
проток.
Аминокислоты
конкурируют друг с другом за специфические
участки связывания белков-переносчиков.
Так, всасывание лейцина в больших
количествах уменьшает всасывание
изолейцина и валина. В крови максимальная
концентрация аминокислот достигается
через 30-50 минут после приема белковой
пищи. Свободные аминокислоты, в отличие
от белков пищи, лишены видовой
специфичности и не обладают антигенными
свойствами.
Скорость
проникновения аминокислот через
мембраны клеток различается, что
указывает на существование транспортных
систем, обеспечивающих перенос
аминокислот через мембраны. Известно
пять специфических транспортных систем
для переноса определенной группы
близких по строению аминокислот:
• нейтральных
с короткой боковой цепью (аланин,
серин, треонин);
• нейтральных
с длинной или разветвленной боковой
цепью (валин,
лейцин, изолейцин);
• с
катионными радикалами (лизин,
аргинин);
• с
анионными радикалами (глутаминовая
и аспарагиновая кислоты);
• иминокислот (пролин,
оксипролин).
Переносчики
аминокислот первой и пятой групп, а
также переносчик метионина относятся
к числу Na+-зависимых. Независимые от
Na+ переносчики специфичны для некоторых
нейтральных аминокислот (фенилаланин,
лейцин) и аминокислот с катионными
радикалами (лизин).
Одной из
основных транспортных систем для
нейтральных аминокислот
является γ-глутамильный
цикл, который
функционирует в почках, поджелудочной
железе, печени и селезенке, в мозге и
других тканях он содержится в очень
небольших количествах (рис. 9.3).
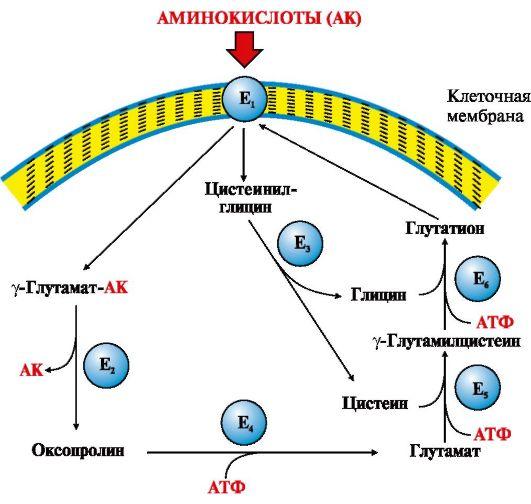 Рис.
Рис.
9.3. γ-Глутамильный цикл:
Е1 –
γ-глутамилтранспептидаза (γ-ГТ); Е2 –
γ-глутамилциклотрансфераза; Е3 –
пептидаза; Е4 –
оксопролиназа; Е5 –
γ-глутамилцистеинсинтетаза; Е6 –
глутатионсинтетаза.
Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием фермента
γ-ГТ. Затем аминокислота освобождается,
а γ-глутамильный остаток в несколько
стадий превращается в глутатион, который
способен присоединять следующую
молекулу аминокислоты
Ключевую
роль в работе системы играет мембранный
фермент γ-глутамилтранспептидаза
(γ-ГТ). Этот
гликопротеин катализирует перенос
γ-глутамильной группы с
глутатиона (γ-глутамилцистеинилглицин)
или другого γ-глутамильного пептида
на транспортируемую аминокислоту и
последующий перенос комплекса в клетку.
Глутатион содержится во всех тканях
животных. Для транспорта в клетку одной
молекулы аминокислоты с участием
γ-глутамильного цикла затрачивается
три молекулы АТР.
γ-ГТ в больших
количествах содержится в почках,
поджелудочной железе, печени и других
тканях. Активность фермента в сыворотке
крови в норме составляет 30-50 МЕ/л
(мкмоль/мин-мг) для мужчин и 25-35 МЕ/л для
женщин. Определение активности γ-ГТ в
сыворотке крови используется для
диагностики заболеваний печени и
сердца. γ-ГТ-тест используется также в
качестве маркера рака поджелудочной
железы, печени, предстательной железы
и для обнаружения людей из группы
раннего риска алкоголизма, для контроля
за лечением хронического алкоголизма.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
