Набухание белков в желудке
Переваривание белков в желудочно-кишечном тракте
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
1. денатурирует белки;
2. стерилизует пищу;
3. вызывает набухание труднорастворимых белков;
4. активирует пепсиноген;
5. создает рН-оптимум для действия пепсина;
6. способствует всасыванию железа;
7. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5-2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0-4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5-8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
Данный текст является ознакомительным фрагментом.
Читайте также
Изменения белков[43]
Изменения белков[43] Те участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет
Глава 2. Строение и функции белков
Глава 2. Строение и функции белков Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.История изучения белковВ 1728 г.
Уровни структурной организации белков
Уровни структурной организации белков Первичная структура – строго определенная линейная последовательность аминокислот в полипептидной цепочке.Стратегические принципы изучения первичной структуры белка претерпевали значительные изменения по мере развития и
Функционирование белков
Функционирование белков Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных
Посттрансляционные изменения белков
Посттрансляционные изменения белков Многие белки синтезируются в неактивном виде (предшественники) и после схождения с рибосом подвергаются постсинтетическим структурным модификациям. Эти конформационные и структурные изменения полипептидных цепей получили
Переваривание углеводов
Переваривание углеводов В слюне содержится фермент ?-амилаза, расщепляющая ?-1,4-гликозидные связи внутри молекул полисахаридов.Переваривание основной массы углеводов происходит в двенадцатиперстной кишке под действием ферментов панкреатического сока – ?-амилазы,
Глава 19. Липиды тканей, переваривание и транспорт липидов
Глава 19. Липиды тканей, переваривание и транспорт липидов Липиды – неоднородная в химическом отношении группа веществ биологического происхождения, общим свойством которых является гидрофобность и способность растворяться в неполярных органических растворителях.
Липиды пищи, их переваривание и всасывание.
Липиды пищи, их переваривание и всасывание. Взрослому человеку требуется от 70 до 145 г липидов в сутки в зависимости от трудовой деятельности, пола, возраста и климатических условий. При рациональном питании жиры должны обеспечивать не более 30% от общей калорийности
Расщепление белков в тканях
Расщепление белков в тканях Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях Нуклеиновые кислоты поступают в организм с пищей главным образом в составе нуклеопротеинов и высвобождаются в результате действия протеолитических ферментов желудочно-кишечного тракта. Далее под
Характеристика белков сыворотки крови
Характеристика белков сыворотки крови Белки системы комплемента – к этой системе относятся 20 белков, циркулирующих в крови в форме неактивных предшественников. Их активация происходит под действием специфических веществ, обладающих протеолитической активностью.
Глава 4. Нарушения нормальных функций желудочно-кишечного тракта
Глава 4. Нарушения нормальных функций желудочно-кишечного тракта Различные нарушения в работе желудочно-кишечного тракта могут быть как временными, так и длительными, возникшими в результате болезни. В обоих случаях владельцу собаки трудно самому установить причину
5 Болезни желудочно-кишечного тракта
5 Болезни желудочно-кишечного тракта Собаки – животные плотоядные. Тем не менее, их организм приспособился к потреблению и усвоению питательных веществ рациона, состоящего из смеси различных кормов. В процессе пищеварения белки, жиры и углеводы пищи подвергаются
Желудочно-кишечный тракт
Желудочно-кишечный тракт Строение пищевода и однокамерного желудка собаки – стандартное для хищников. 12-перстная кишка висит на короткой брыжейке. От пилорической части желудка она отходит в правое подреберье, направляется вдоль печени по правой стенке брюшной полости
3.8. Защитные системы желудочно-кишечного тракта
3.8. Защитные системы желудочно-кишечного тракта Теория адекватного питания придает большое значение системам защиты организма от проникновения различных вредных веществ в его внутреннюю среду. Поступление пищевых веществ в желудочно-кишечный тракт следует
3.8. Защитные системы желудочно-кишечного тракта
3.8. Защитные системы желудочно-кишечного тракта Теория адекватного питания придает большое значение системам защиты организма от проникновения различных вредных веществ в его внутреннюю среду. Поступление пищевых веществ в желудочно-кишечный тракт следует
Источник
Переваривание- процесс гидролиза веществ до их ассимилируемых форм.
Всасывание – процесс поступления веществ из просвета ЖКТ в кровеносное русло.
В пищевых продуктах содержатся в основном белки и пептиды, которые, как правило, не способны всасываться, ассимилируемых свободных аминокислот в пище очень мало.
Переваривание белков и пептидов в ЖКТ происходит под действием пищеварительных соков, содержащих ферменты протеазы, которые относятся к классу гидролаз.
Протеазыгидролизуют пептидных связей в белках и пептидах, их делят напротеиназы(эндопептидазы) ипептидазы(экзопептидазы).
Протеиназы(эндопептидазы) катализируют расщепление внутренних пептидных связей в белках и пептидах.
Пептидазы (экзопептидазы)отщепляют от молекул белков и пептидов по одной аминокислоте с карбоксильного или аминного конца. Соответственно различаюткарбоксипептидазыиаминопептидазы. Экзопептидазы функционируют в тонкой кишке.
Дипептидазыгидролизуют дипептиды.
В зависимости от особенностей строения активного центра протеазы подразделяют на сериновые, тиоловые (цистеиновые), кислые протеиназы и металлоферменты, содержащие в активном центре атом металла (чаще Zn). К металлоферментам относится большинство известных пептидаз.
Протеазы различают по субстратной специфичности, т. е. способности гидролизовать связи между определёнными аминокислотными остатками.
Переваривание белков начинается в желудке.
Переваривание белков в желудке
Желудок выполняет несколько функций: защитную (обезвреживание пищи: HCl, лизоцим), переваривание (механическая и химическая обработка пищи: HCl, ферменты), всасывание, эндокринную (образование гастрина и гистамина) и экскреторную (выделение мочевины, мочевой кислоты, аммиака, креатинина, солей тяжелых металлов, йода, лекарственных веществ).
Основная пищеварительная функция желудка – переваривание белка. Для пищеварения слизистая оболочка желудкавыделяет сложный по составу сок, который представляет собой бесцветную, слегка опалесцирующую жидкость с величиной рН=1,5-2,0 (1,6-1,8) и относительной плотностью 1005. В сутки выделяется 2-2,5 литра сока. Основной компонент желудочного сока вода (99,5%) в которой растворены органические и неорганические вещества.
Состав желудочного сока
Неорганические вещества | Кол-во | Органические вещества | Кол-во |
Свободная НС1 | 20 ммоль/л, 0,4-0,5% 20-40 ТЕ | Пепсины (8 видов) | 0-21 мг% |
Связанная НС1 | 20-30 ТЕ | Ренин (только у грудных детей) | |
Хлориды | 155,1 ммоль/л | Гастриксин | |
Натрий | 31,3-189,3 ммоль/л | Желатиназа | |
Калий | 5,6-35,3 ммоль/л | Липаза | |
кальций | Муцин | ||
магний | Лизоцим | ||
Азот небелковый | 14,3-34,3 ммоль/л | Органические кислоты | |
Азот мочевины и аммиака | 4,99-9,99 ммоль/л | ||
Азот аминокислот | 47,6-118,9 мкмоль/л | ||
Сульфаты | |||
фосфаты | |||
бикарбонаты |
Желудочный сок синтезируется железами, находящимися в слизистой оболочке желудка. Различают три вида желез: кардиальные, фундальные (собственные железы желудка) и пиллорические (железы привратника). Железы состоят из главных, париетальных (обкладочных), добавочных клеток и мукоцитов.
Главные клетки вырабатывают пепсиногены (пепсин, гастриксин, реннин), обкладочные (париетальные) – соляную кислоту, добавочные и мукоциты – мукоидный секрет. Фундальные железы содержат все три типа клеток.
Кислотность желудочного сока
Кислотность желудочного сока связана с наличием в нем различных неорганических (HCl, кислые фосфаты) и органических (оксо-, окси-, амино-, нуклеиновые, жирные кислоты и т.д.) кислот. В связи с этим выделяют понятие общая кислотность желудочного сока.Основная причина кислотности желудочного сока связана с наличием в нем соляной кислоты. Соляная кислота в желудочном соке находится в свободном и в связанном (с белками и продуктами их переваривания) состоянии.
Механизм образования соляной кислоты
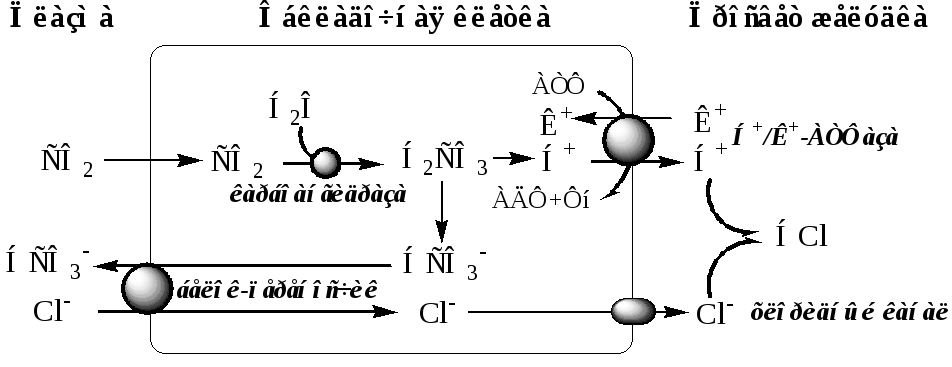
Согласно карбоангидразной теории, источником Н+ для HCl является Н2СО3, которая образуется в обкладочных клетках желудка из СО2 и Н2О под действием карбоангидразы: Н2О + СО2 → Н2СО3
Н2СО3 диссоциирует на бикарбонат, который выделяется в плазму крови в обмен на С1-, и Н+, который активно переносится Н+/К+-АТФ-азой в просвет желудка в обмен на К+.
При этом в просвете желудка концентрация Н+ увеличивается в 106 раз, концентрация НС1 достигает 0,16 М, а значения рН снижается до 1,0-2,0. При максимальной активности обкладочные клетки могут продуцировать до 23 ммоль HCl в час. Синтез HCl – аэробный процесс, требующий большого количества АТФ, поэтому при гипоксии он снижается.
Вода выходит из клеток в просвет желудка по осмотическому градиенту

Функции НС1:
Вызывает денатурацию и набухание белков пищи, что увеличивает доступность их пептидных связей для действия протеаз;
Обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник;
Регуляция активности протеолитических ферментов (активирует пепсиноген и создаёт оптимум рН для протеолитических ферментов);
Стимулирует работу кишечника и поджелудочной железы.
Ферменты желудка
Пепсиноген неактивный фермент, синтезируется в главных клетках, состоит из одной полипептидной цепи с молекулярной массой 40 кД.
В просвете желудка под действием НС1 от N-конца пепсиногена отщепляется пептид в 42 аминокислотных остатка, который содержит почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. При этом пепсиноген превращается в активный пепсин, он состоит преимущественно из отрицательно заряженных аминокислот, которые участвуют в формировании активного центра. Образовавшиеся под действием НС1 активные молекулы пепсина быстро активируют остальные молекулы пепсиногена аутокатализом.
Пепсин- белок,с молекулярной массой 34,5 кДа, 340АК, 3 дисульфидных мостика и фосфорная кислота.Пепсин – эндопептидаза с оптимумом рН=1,9.
. Пепсин гидролизует внутренниепептидные связи в белке (кроме кератинов и других склеропротеинов) с образованием коротких пептидов и АК: хорошо – между ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и хуже – между лейцином и дикарбоновыми аминокислотами.Естественным ингибитором пепсина является пепстатин.
Всего известно до 12 изоформ пепсина, которые различаются молекулярным весом, электрофоретической подвижностью, оптимумами рН протеолитической активности, при разном рН с неодинаковой скоростью гидролизуют разные белки, условиями инактивации.
Пепсин 1 (собственно пепсин) – максимум активности при рН = 1,9. При рН = 6 быстро инактивируется.
Пепсин 2 – максимум активности при рН = 2,1.
Пепсин 3 – максимум активности при рН = 2,4 – 2,8.
Пепсин 5 («гастриксин») – максимум активности при рН = 2,8 – 3,4.
Пепсин 7 – максимум активности при рН = 3,3 – 3,9.
Реннин (химозин, сычужный фермент) – эндопептидаза,с оптимумом рН=3-4. В составе преобладают кислые аминокислоты, вырабатывается главными клетками в виде прореннина (прохимозина). Активируется при рН<5, в присутствии кальция отщеплением пептида в 42 АК. Реннин вызывает створаживание молока в присутствии ионов кальция. Есть только у детей грудного возраста. Основной белок молока – казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Параказеин медленно расщепляется под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НС1 и пепсина.
Муцин – мукопротеид образующийслизь. Существует в 2 формах: нерастворимая фракция – покрывает поверхность слизистой оболочки и изолирует эпителий от пищеварительного процесса (механическая и химическая защита); растворимая фракция – образует коллоидную систему, в которой растворены компоненты желудочного сока. Обладает буферными свойствами, способна нейтрализовать кислотность или щелочность.
Внутренний фактор Касла (гастромукопротеид) – комплексное соединение, состоящее из пептидов, отщепляющихся от пепсиногена при его превращении в пепсин, и мукоидов – секрета, выделяемого клетками слизистой оболочки желудка (мукоцитами).
Мукоидная часть комплекса защищает его от гидролиза пищеварительными ферментами и утилизации бактериями кишечника; белковая часть определяет его физиологическую активность. Основная роль внутреннего фактора Касла заключается в образовании с витамином В12 лабильного комплекса, который всасывается эпителиальными клетками подвздошной кишки.
Всасывание усиливается в присутствии ионов кальция, бикарбонатов и ферментов поджелудочной железы. В плазме крови витамин В12 связывается с белками плазмы, образуя белково-В12-витаминный комплекс, который депонируется в печени.
Лизоцим- белок, обеспечивающий бактерицидные свойства желудочного сока.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
