Какими клетками желудка вырабатывается пепсиноген
Общая информация об исследовании
Пепсиноген – предшественник фермента пепсина, обеспечивающего начальный этап переваривания белков. Он вырабатывается клетками слизистой оболочки желудка как неактивный профермент, который под воздействием соляной кислоты превращается в активный пепсин. Различают два вида пепсиногена: пепсиноген I и пепсиноген II. Пепсиноген I образуется исключительно в главных клетках слизистой желудка, находящихся только в теле желудка. В норме в кровь выделяется небольшое количество пепсиногена I, которое может быть измерено при лабораторной диагностике.
Тело желудка является единственным отделом, где происходит синтез соляной кислоты и внутреннего фактора, необходимого для всасывания витамина B12. При заболеваниях, поражающих тело желудка, синтез пепсиногена I, соляной кислоты и внутреннего фактора значительно снижается. Так как изменение концентрации пепсиногена I наиболее точно отражает тяжесть и степень поражения тела желудка, этот клинико-лабораторный показатель используется при диагностике заболеваний тела желудка и наблюдении за их течением.
Самой частой причиной воспаления слизистой оболочки желудка является инфицирование грамотрицательной спиралевидной бактерией Helicobacter pylori (H. pylori). Она устойчива к воздействию соляной кислоты и поэтому способна колонизировать слизистую оболочку желудка. Эта бактерия выделяет цитотоксины и протеазы, которые постепенно разрушают слизистую желудка, что приводит к атрофическому гастриту. Он сначала поражает антральный и пилорический отдел, а затем и тело желудка. Атрофия может быть выражена в той или иной степени в разных отделах желудка, что дало основание для выделения форм атрофического гастрита: атрофический антральный гастрит, атрофический гастрит тела желудка и атрофический пангастрит. Необходимо отметить, что не у всех пациентов с атрофическим гастритом выявляется активная инфекция H. Pylori – это говорит о том, что данный микроорганизм – лишь одна из причин гастрита, который в дальнейшем поддерживается другими факторами (курением, употреблением алкоголя, регулярным применением нестероидных противовоспалительных препаратов). Только у половины пациентов, инфицированных H. pylori, в итоге возникает атрофический гастрит, что свидетельствует об индивидуальной восприимчивости к повреждающему воздействию этого микроорганизма.
В ответ на инфекцию H. pylori вырабатываются специфические антитела. Установлено, что некоторые антигены H. pylori имеют структурное сходство с антигенами основного фермента обкладочных клеток, синтезирующих соляную кислоту (H+-K+-ATPase). Этот феномен назван молекулярной мимикрией. Ее результатом является то, что защитные антитела против H. pylori вступают в перекрестную реакцию с антигенами собственных обкладочных клеток, что приводит к их гибели. Наличие аутоантител к обкладочным клеткам слизистой желудка – характерная особенность аутоиммунного атрофического гастрита. Считается, что он развивается на фоне длительно протекающей инфекции H. pylori у предрасположенных к нему лиц. Аутоиммунный гастрит часто сопровождается другими аутоиммунными заболеваниями: сахарным диабетом 1-го типа, витилиго и аутоиммунным тиреоидитом Хашимото.
Как правило, атрофический гастрит развивается медленно, без выраженных симптомов. Пациенты могут испытывать несильную боль в области эпигастрия, чувство быстрого насыщения и переполнения желудка, тошноту, слабость. Постепенное разрушение обкладочных клеток приводит к ахлоргидрии и дефициту внутреннего фактора. Соляная кислота необходима для нормального переваривания белка, высвобождения связанного с пищевым белком витамина В12, а также для окисления соединений кальция, железа, цинка и магния в формы, доступные для всасывания в двенадцатиперстной кишке. Ахлоргидрия приводит к нехватке витамина В12, которая может проявляться изменениями со стороны крови, желудочно-кишечного тракта и нервной системы. Возникающая при этом макроцитарная анемия сопровождается слабостью, головокружением и учащенным сердцебиением. Изменения желудочно-кишечного тракта вызывают нарушение переваривания и, соответственно, диарею. Особо опасны нарушения нервной системы: демиелинизация аксонов трактов спинного мозга необратима и может привести к параличу и нарушениям чувствительности.
Выраженная деструкция обкладочных клеток и ахлоргидрия наиболее характерны для аутоиммунного атрофического гастрита. При атрофическом гастрите тела желудка, а также при пангастрите вместе с обкладочными клетками гибнут и главные, что отражается в понижении концентрации пепсиногена I в крови, поэтому он является клинико-лабораторным индикатором повреждения тела желудка и используется в диагностике атрофического гастрита тела желудка и пангастрита. К тому же существует взаимосвязь между тяжестью атрофического гастрита и степенью снижения концентрации пепсиногена I крови. Благодаря этому тест на пепсиноген I может быть полезен на этапе контроля за эффективностью лечения атрофического гастрита после курса антибиотиков.
Соляная кислота обеспечивает естественную защиту против патогенных микроорганизмов. При ахлоргидрии этот барьер нарушен, что выражается большей уязвимостью перед кишечными инфекциями (в частности, лямблиозом и псевдомембранозным колитом).
Пациентам с гиперацидным гастритом, при котором секреция соляной кислоты повышена, часто назначаются ингибиторы протонной помпы (например, омепразол). Длительное подавление секреции соляной кислоты обкладочными клетками приводит к постепенной атрофии этих клеток. Поэтому тем, кто применяет блокаторы протонной помпы более 1 года, необходимо проверять уровень пепсиногена I для того, чтобы узнавать о необходимости продолжения лечения или его коррекции.
Атрофический гастрит – самый значимый фактор риска развития аденокарциномы желудка. Разрушение нормальных клеток слизистой оболочки желудка при нем сопровождается появлением очагов метаплазии. При метаплазии происходит замена желудочного эпителия на эпителий кишечного типа, гораздо менее устойчивый к воздействию соляной кислоты. Такие очаги метаплазии являются предраковыми состояниями: аденокарцинома желудка развивается у 2,5-5 % пациентов с атрофическим гастритом тяжелой и средней тяжести, тяжелый атрофический пангастрит связан с 90-кратным увеличением риска развития аденокарциномы. К факторам риска аденокарциномы желудка также относятся: употребление большого количества пищи, содержащей нитраты, копченых продуктов, алкоголя, курение, инфицирование H. pylori, лучевая терапия, наследственность, а также наличие других предраковых состояний (желудочного полипа, болезни Менетрие). Как правило, пациенты с аденокарциномой желудка обращаются к врачу уже на поздней стадии, когда опухоль достигла крупных размеров и есть метастазы. Это связано с тем, что длительное время аденокарцинома сопровождается неспецифическими симптомами: слабостью, дискомфортом в области эпигастрия, потерей веса. Боль, рвота, желудочное кровотечение, асцит говорят уже о далеко зашедшем процессе. В связи с этим пациентам, входящим в группу риска по развитию аденокарциномы, необходимо регулярно обследоваться. Инвазивные процедуры (эндоскопия с биопсией участков атрофии/метаплазии) и радиологические методики (рентгенологическое исследование с контрастированием) не используются в качестве скрининга, так как могут вызвать осложнения. В этой ситуации анализ на пепсиноген I является удобным способом оценить состояние слизистой оболочки тела желудка.
Сочетание тестов на пепсиноген I, пепсиноген II, гастрин 17 и на активную инфекцию H. pylori позволяет точно охарактеризовать состояние слизистой оболочки всех отделов желудка, не прибегая к инвазивным методикам. Нормальные показатели такого комплексного теста свидетельствуют о хорошем состоянии слизистой оболочки, когда эндоскопия не требуется. Наоборот, у пациентов с низкой концентрацией пепсиногена I и низким коэффициентом “пепсиноген I / пепсиноген II” вероятно наличие атрофического гастрита тела желудка, пангастрита, а также аденокарциномы, что должно быть подтверждено с помощью эндоскопического и гистологического исследования. Чувствительность такого комплексного теста составляет 71-83 %, а специфичность – 95-98 %.
При атрофическом гастрите тела желудка повышен риск развития опухолей из энтерохромаффинных клеток желудка – карциноидных опухолей. Они встречаются редко, у пациентов с аутоиммунным атрофическим гастритом вероятность их возникновения составляет около 5 %. Опухолевые клетки секретируют в большом количестве 5-гидрокситриптофан, вызывающий характерные симптомы карциноида – чувство прилива крови к лицу и диарею. Карциноиды крупных размеров могут приводить к желудочному кровотечению и обструкции желудка.
Для чего используется исследование?
- Для диагностики атрофического гастрита тела желудка и пангастрита у пациентов, входящих в группу риска по развитию атрофического гастрита, с симптомами желудочной диспепсии или сопутствующими аутоиммунными заболеваниями.
- Для оценки необходимости проводить инвазивные и радиологические исследования при симптомах желудочной диспепсии.
- Чтобы оценить состояние слизистой оболочки желудка пациентов, получающих ингибиторы протонной помпы (омепразол, лансопразол) более 1 года.
- Для ранней диагностики аденокарциномы и карциноида желудка.
Когда назначается исследование?
- При симптомах дефицита витамина В12: слабости, головокружения, учащённом сердцебиении, диарее, нарушении чувствительности и парезе.
- При симптомах дефицита микро- и макроэлементов: цинка (замедление заживления ран, поредение волос, снижение остроты обоняния и вкуса), кальция (патологические переломы, судороги), магния (судороги), железа (слабость, одышка, ломкость волос и ногтей).
- При наличии факторов риска развития атрофического гастрита (инфицирование H. pylori, курение, употребление алкоголя, регулярное применение медикаментов (ацетилсалициловой кислоты, диклофенака, ибупрофена, кеторолака, мелоксикама).
- При аутоиммунных заболеваниях: сахарном диабете I типа, аутоиммунном тиреоидите Хашимото, витилиго.
- При симптомах желудочной диспепсии: дискомфорте в эпигастральной области, чувстве быстрого насыщения и переполнения желудка, тошноте, слабости.
- При наличии факторов риска развития аденокарциномы желудка: атрофический гастрит, употребление пищи с высоким содержанием нитратов, копчёных продуктов и большого количества алкоголя, курение, наследственность, желудочные полипы.
- При применении ингибиторов протонной помпы (омепразола, лансопрозола) более 1 года.
Источник
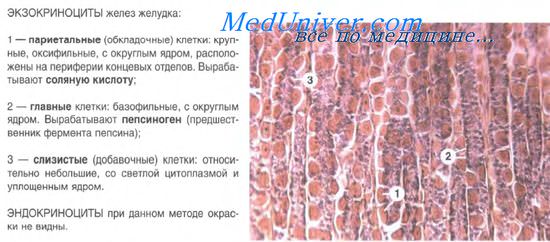
Эпителий желез желудка. Клетки желудка. Гормоны желудка.
Эпителий желез желудка представляет собой высокоспециализированную ткань, состоящую из нескольких клеточных дифферонов, камбием для которых служат малодифференцированные эпителиоциты в области шеек желез. Эти клетки интенсивно метятся при введении Н-тимидина, часто делятся митозом, составляя камбий как для поверхностного эпителия слизистой оболочки желудка, так и для эпителия желудочных желез. Соответственно этому дифференцировка и смещение вновь возникающих клеток идут в двух направлениях: в сторону поверхностного эпителия и в глубину желез. Обновление клеток в эпителии желудка происходит за 1-3 суток.
Значительно медленнее обновляются высокоспециализированные клетки эпителия желудочных желез.
Главные экзокриноциты вырабатывают профермент пепсиноген, который в кислой среде превращается в активную форму пепсин — главный компонент желудочного сока. Экзокриноциты имеют призматическую форму, хорошо развитую гранулярную эндоплазматическую сеть, базофильную цитоплазму с секреторными гранулами зимогена.
Париетальные экзокриноциты — крупные, округлой или неправильно угловатой формы клетки, расположенные в составе стенки железы кнаружи от главных экзокриноцитов и мукоцитов. Цитоплазма клеток резко оксифильна. В ней содержатся многочисленные митохондрии. Ядро лежит в центральной части клетки. В цитоплазме есть система внутриклеточных секреторных канальцев, переходящих в межклеточные канальцы. В просвет внутриклеточных канальцев выступают многочисленные микроворсинки. По секреторным канальцам из клетки на апикальную ее поверхность выводятся ионы Н и Сl, образующие соляную кислоту.
Париетальные клетки секретируют также внутренний фактор Кастла, необходимый для всасывания витамина Bi2 в тонкой кишке.

Мукоциты — слизистые клетки призматической формы со светлой цитоплазмой и уплотненным ядром, смещенным в базальную часть. При электронной микроскопии в апикальной части слизистых клеток выявляется большое количество секреторных гранул. Располагаются мукоциты в главной части желез, преимущественно в теле собственных желез. Функция клеток — выработка слизи.
Эндокриноциты желудка представлены несколькими клеточными дифферонами, для названия которых приняты буквенные сокращенные обозначения (ЕС, ECL, G, P, D, А и др.). Для всех этих клеток характерна более светлая цитоплазма, чем у других эпителиальных клеток. Отличительным признаком эндокринных клеток является наличие в цитоплазме секреторных гранул. Поскольку гранулы способны восстанавливать нитрат серебра, эти клетки называют аргирофильными. Они интенсивно окрашиваются также бихроматом калия, с чем связано другое название эндокриноцитов — энтерохромаффинные.
На основании строения секреторных гранул, а также с учетом их биохимических и функциональных свойств эндокриноциты классифицируются на несколько видов.
ЕС-клетки самые многочисленные, располагаются в теле и дне железы, между главными экзокриноцитами и секретируют серотонин и мелатонин. Серотонин стимулирует секреторную деятельность главных экзокриноцитов и мукоцитов. Мелатонин участвует в регуляции биологических ритмов функциональной активности секреторных клеток в зависимости от световых циклов.
ECL-клетки вырабатывают гистамин, который действует на париетальные экзокриноциты, регулируя продукцию соляной кислоты.
G-клетки называют гастринпродуцирующими. В большом количестве они встречаются в пилорических железах желудка. Гастрин стимулирует деятельность главных и париетальных экзокриноцитов, что сопровождается усиленной выработкой пепсиногена и соляной кислоты. У людей с повышенной кислотностью желудочного сока отмечается увеличение количества G-клеток и их гиперфункция. Имеются данные о том, что G-клетки вырабатывают энкефалин — морфиноподобное вещество, впервые обнаруженное в мозгу и участвующее в регуляции чувства боли.
Р-клетки секретируют бомбезин, который усиливает сокращения гладкой мышечной ткани желчного пузыря, стимулирует выделение соляной кислоты париетальными экзокриноцитами.
D-клетки вырабатывают соматостатин — ингибитор гормона роста. Он угнетает синтез белков.
ВИП-клетки продуцируют вазоинтестинальный пептид, расширяющий кровеносные сосуды и снижающий артериальное давление. Этот пептид стимулирует также выделение гормонов клетками островков поджелудочной железы.
А-клетки синтезируют энтероглюкагон, расщепляющий гликоген до глюкозы подобно глюкагону А-клеток островков поджелудочной железы.
В большинстве эндокриноцитов секреторные гранулы находятся в базальной части. Содержимое гранул выделяется в собственную пластинку слизистой оболочки и далее попадает в кровеносные капилляры.
Мышечная пластинка слизистой оболочки образована тремя слоями гладких миоцитов.
Подслизистая основа стенки желудка представлена рыхлой волокнистой соединительной тканью с сосудистыми и нервными сплетениями.
Мышечная оболочка желудка состоит из трех слоев гладкой мышечной ткани: наружного продольного, среднего циркулярного и внутреннего с косым направлением мышечных пучков. Средний слой в области привратника утолщен и образует пилорический сфинктер. Серозная оболочка желудка образована поверхностно лежащим мезотелием, а ее основу составляет рыхлая волокнистая соединительная ткань.
В стенке желудка расположены подслизистое, межмышечное и подсерозное нервные сплетения. В ганглиях межмышечного сплетения преобладают вегетативные нейроны 1-го типа, в пилорической области желудка больше нейронов П-го типа. К сплетениям идут проводники от блуждающего нерва и из пограничного симпатического ствола. Возбуждение блуждающего нерва стимулирует секрецию желудочного сока, тогда как возбуждение симпатических нервов, наоборот, угнетает желудочную секрецию.
– Также рекомендуем “Тонкая кишка. Развитие тонкой кишки. Строение тонкой кишки.”
Оглавление темы “Строение желудка. Строение кишечника.”:
1. Пищевод. Слизистая пищевода. Строение стенки пищевода.
2. Желудок. Развитие желудка. Строение желудка. Железы желудка.
3. Эпителий желез желудка. Клетки желудка. Гормоны желудка.
4. Тонкая кишка. Развитие тонкой кишки. Строение тонкой кишки.
5. Эпителий тонкой кишки. Клетки тонкой кишки.
6. Толстая кишка. Развитие и строение толстой кишки. Червеобразный отросток.
7. Прямая кишка. Строение прямой кишки. Поджелудочная железа.
8. Эндокринная часть поджелудочной железы. Регенерация поджелудочной железы.
9. Печень. Развитие печени. Строение печени.
10. Гепатоциты. Строение гепатоцитов. Образование желчи.
Источник
Пепсиноген I – это предшественник фермента пепсина, необходимого для переваривания белка. Он является индикатором повреждения слизистой оболочки тела желудка.
Синонимы английские
Pepsinogen I, PGI, PgI.
Метод исследования
Иммунохемилюминесцентный анализ.
Единицы измерения
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Пепсиноген – предшественник фермента пепсина, обеспечивающего начальный этап переваривания белков. Он вырабатывается клетками слизистой оболочки желудка как неактивный профермент, который под воздействием соляной кислоты превращается в активный пепсин. Различают два вида пепсиногена: пепсиноген I и пепсиноген II. Пепсиноген I образуется исключительно в главных клетках слизистой желудка, находящихся только в теле желудка. В норме в кровь выделяется небольшое количество пепсиногена I, которое может быть измерено при лабораторной диагностике.
Тело желудка является единственным отделом, где происходит синтез соляной кислоты и внутреннего фактора, необходимого для всасывания витамина B12. При заболеваниях, поражающих тело желудка, синтез пепсиногена I, соляной кислоты и внутреннего фактора значительно снижается. Так как изменение концентрации пепсиногена I наиболее точно отражает тяжесть и степень поражения тела желудка, этот клинико-лабораторный показатель используется при диагностике заболеваний тела желудка и наблюдении за их течением.
Самой частой причиной воспаления слизистой оболочки желудка является инфицирование грамотрицательной спиралевидной бактерией Helicobacter pylori (H. pylori). Она устойчива к воздействию соляной кислоты и поэтому способна колонизировать слизистую оболочку желудка. Эта бактерия выделяет цитотоксины и протеазы, которые постепенно разрушают слизистую желудка, что приводит к атрофическому гастриту. Он сначала поражает антральный и пилорический отдел, а затем и тело желудка. Атрофия может быть выражена в той или иной степени в разных отделах желудка, что дало основание для выделения форм атрофического гастрита: атрофический антральный гастрит, атрофический гастрит тела желудка и атрофический пангастрит. Необходимо отметить, что не у всех пациентов с атрофическим гастритом выявляется активная инфекция H. Pylori – это говорит о том, что данный микроорганизм – лишь одна из причин гастрита, который в дальнейшем поддерживается другими факторами (курением, употреблением алкоголя, регулярным применением нестероидных противовоспалительных препаратов). Только у половины пациентов, инфицированных H. pylori, в итоге возникает атрофический гастрит, что свидетельствует об индивидуальной восприимчивости к повреждающему воздействию этого микроорганизма.
В ответ на инфекцию H. pylori вырабатываются специфические антитела. Установлено, что некоторые антигены H. pylori имеют структурное сходство с антигенами основного фермента обкладочных клеток, синтезирующих соляную кислоту (H+-K+-ATPase). Этот феномен назван молекулярной мимикрией. Ее результатом является то, что защитные антитела против H. pylori вступают в перекрестную реакцию с антигенами собственных обкладочных клеток, что приводит к их гибели. Наличие аутоантител к обкладочным клеткам слизистой желудка – характерная особенность аутоиммунного атрофического гастрита. Считается, что он развивается на фоне длительно протекающей инфекции H. pylori у предрасположенных к нему лиц. Аутоиммунный гастрит часто сопровождается другими аутоиммунными заболеваниями: сахарным диабетом 1-го типа, витилиго и аутоиммунным тиреоидитом Хашимото.
Как правило, атрофический гастрит развивается медленно, без выраженных симптомов. Пациенты могут испытывать несильную боль в области эпигастрия, чувство быстрого насыщения и переполнения желудка, тошноту, слабость. Постепенное разрушение обкладочных клеток приводит к ахлоргидрии и дефициту внутреннего фактора. Соляная кислота необходима для нормального переваривания белка, высвобождения связанного с пищевым белком витамина В12, а также для окисления соединений кальция, железа, цинка и магния в формы, доступные для всасывания в двенадцатиперстной кишке. Ахлоргидрия приводит к нехватке витамина В12, которая может проявляться изменениями со стороны крови, желудочно-кишечного тракта и нервной системы. Возникающая при этом макроцитарная анемия сопровождается слабостью, головокружением и учащенным сердцебиением. Изменения желудочно-кишечного тракта вызывают нарушение переваривания и, соответственно, диарею. Особо опасны нарушения нервной системы: демиелинизация аксонов трактов спинного мозга необратима и может привести к параличу и нарушениям чувствительности.
Выраженная деструкция обкладочных клеток и ахлоргидрия наиболее характерны для аутоиммунного атрофического гастрита. При атрофическом гастрите тела желудка, а также при пангастрите вместе с обкладочными клетками гибнут и главные, что отражается в понижении концентрации пепсиногена I в крови, поэтому он является клинико-лабораторным индикатором повреждения тела желудка и используется в диагностике атрофического гастрита тела желудка и пангастрита. К тому же существует взаимосвязь между тяжестью атрофического гастрита и степенью снижения концентрации пепсиногена I крови. Благодаря этому тест на пепсиноген I может быть полезен на этапе контроля за эффективностью лечения атрофического гастрита после курса антибиотиков.
Соляная кислота обеспечивает естественную защиту против патогенных микроорганизмов. При ахлоргидрии этот барьер нарушен, что выражается большей уязвимостью перед кишечными инфекциями (в частности, лямблиозом и псевдомембранозным колитом).
Пациентам с гиперацидным гастритом, при котором секреция соляной кислоты повышена, часто назначаются ингибиторы протонной помпы (например, омепразол). Длительное подавление секреции соляной кислоты обкладочными клетками приводит к постепенной атрофии этих клеток. Поэтому тем, кто применяет блокаторы протонной помпы более 1 года, необходимо проверять уровень пепсиногена I для того, чтобы узнавать о необходимости продолжения лечения или его коррекции.
Атрофический гастрит – самый значимый фактор риска развития аденокарциномы желудка. Разрушение нормальных клеток слизистой оболочки желудка при нем сопровождается появлением очагов метаплазии. При метаплазии происходит замена желудочного эпителия на эпителий кишечного типа, гораздо менее устойчивый к воздействию соляной кислоты. Такие очаги метаплазии являются предраковыми состояниями: аденокарцинома желудка развивается у 2,5-5 % пациентов с атрофическим гастритом тяжелой и средней тяжести, тяжелый атрофический пангастрит связан с 90-кратным увеличением риска развития аденокарциномы. К факторам риска аденокарциномы желудка также относятся: употребление большого количества пищи, содержащей нитраты, копченых продуктов, алкоголя, курение, инфицирование H. pylori, лучевая терапия, наследственность, а также наличие других предраковых состояний (желудочного полипа, болезни Менетрие). Как правило, пациенты с аденокарциномой желудка обращаются к врачу уже на поздней стадии, когда опухоль достигла крупных размеров и есть метастазы. Это связано с тем, что длительное время аденокарцинома сопровождается неспецифическими симптомами: слабостью, дискомфортом в области эпигастрия, потерей веса. Боль, рвота, желудочное кровотечение, асцит говорят уже о далеко зашедшем процессе. В связи с этим пациентам, входящим в группу риска по развитию аденокарциномы, необходимо регулярно обследоваться. Инвазивные процедуры (эндоскопия с биопсией участков атрофии/метаплазии) и радиологические методики (рентгенологическое исследование с контрастированием) не используются в качестве скрининга, так как могут вызвать осложнения. В этой ситуации анализ на пепсиноген I является удобным способом оценить состояние слизистой оболочки тела желудка.
Сочетание тестов на пепсиноген I, пепсиноген II, гастрин 17 и на активную инфекцию H. pylori позволяет точно охарактеризовать состояние слизистой оболочки всех отделов желудка, не прибегая к инвазивным методикам. Нормальные показатели такого комплексного теста свидетельствуют о хорошем состоянии слизистой оболочки, когда эндоскопия не требуется. Наоборот, у пациентов с низкой концентрацией пепсиногена I и низким коэффициентом “пепсиноген I / пепсиноген II” вероятно наличие атрофического гастрита тела желудка, пангастрита, а также аденокарциномы, что должно быть подтверждено с помощью эндоскопического и гистологического исследования. Чувствительность такого комплексного теста составляет 71-83 %, а специфичность – 95-98 %.
При атрофическом гастрите тела желудка повышен риск развития опухолей из энтерохромаффинных клеток желудка – карциноидных опухолей. Они встречаются редко, у пациентов с аутоиммунным атрофическим гастритом вероятность их возникновения составляет около 5 %. Опухолевые клетки секретируют в большом количестве 5-гидрокситриптофан, вызывающий характерные симптомы карциноида – чувство прилива крови к лицу и диарею. Карциноиды крупных размеров могут приводить к желудочному кровотечению и обструкции желудка.
Для чего используется исследование?
- Для диагностики атрофического гастрита тела желудка и пангастрита у пациентов, входящих в группу риска по развитию атрофического гастрита, с симптомами желудочной диспепсии или сопутствующими аутоиммунными заболеваниями.
- Для оценки необходимости проводить инвазивные и радиологические исследования при симптомах желудочной диспепсии.
- Чтобы оценить состояние слизистой оболочки желудка пациентов, получающих ингибиторы протонной помпы (омепразол, лансопразол) более 1 года.
- Для ранней диагностики аденокарциномы и карциноида желудка.
Когда назначается исследование?
- При симптомах дефицита витамина В12: слабости, головокружения, учащённом сердцебиении, диарее, нарушении чувствительности и парезе.
- При симптомах дефицита микро- и макроэлементов: цинка (замедление заживления ран, поредение волос, снижение остроты обоняния и вкуса), кальция (патологические переломы, судороги), магния (судороги), железа (слабость, одышка, ломкость волос и ногтей).
- При наличии факторов риска развития атрофического гастрита (инфицирование H. pylori, курение, употребление алкоголя, регулярное применение медикаментов (ацетилсалициловой кислоты, диклофенака, ибупрофена, кеторолака, мелоксикама).
- При аутоиммунных заболеваниях: сахарном диабете I типа, аутоиммунном тиреоидите Хашимото, витилиго.
- При симптомах желудочной диспепсии: дискомфорте в эпигастральной области, чувстве быстрого насыщения и переполнения желудка, тошноте, слабости.
- При наличии факторов риска развития аденокарциномы желудка: атрофический гастрит, употребление пищи с высоким содержанием нитратов, копчёных продуктов и большого количества алкоголя, курение, наследственность, желудочные полипы.
- При применении ингибиторов протонной помпы (омепразола, лансопрозола) более 1 года.
Что означают результаты?
Референсные значения: > 70 нг/мл.
Причины повышения уровня пепсиногена I:
- язва двенадцатиперстной кишки,
- инфицирование H. pylori,
- гастринома,
- хроническая почечная недостаточность,
- регулярное применение ингибиторов протонной помпы в течение короткого срока.
Причины понижения уровня пепсиногена I:
- атрофический гастрит тела желудка или пангастрит,
- пернициозная анемия,
- аденокарцинома и карциноид желудка,
- аутоиммунный тиреоидит, сахарный диабет I типа,
- ваготомия, резекция желудка,
- гипофункция аденогипофиза,
- регулярное применение ингибиторов протонной помпы в течение длительного срока (больше 1 года).
Что может влиять на результат?
Концентрация пепсиногена I повышается с возрастом и при хронической почечной недостаточности.
Важные замечания
Анализ на пепсиноген I следует производить в комплексе с тестами на другие показатели, отражающие состояние слизистой оболочки желудка (гастрин, пепсиноген II, антитела к H. pylori и антиген H. pylori).
Также рекомендуется
- Helicobacter pylori, IgG (количественно)
- Helicobacter pylori, ДНК [реал-тайм ПЦР]
- Helicobacter pylori, антиген
- Гастрин
- Пепсиноген II
Кто назначает исследование?
Врач общей практики, гастроэнтеролог, онколог.
Литература
- LARS AGRÉUS et al. Rationale in diagnosis and screening of atrophic gastritis with stomach-specific plasma biomarkers. Scandinavian Journal of Gastroenterology. 2012; 47: 136–147.
- Edith Lahner, Bruno Annibale. Pernicious anemia: New insights from a gastroenterological point of view. World J Gastroenterol 2009 November 7; 15(41): 5121-5128.
- Chisato Hamashima et al. The Japanese Guidelines for Gastric Cancer Screening. Jpn J Clin Oncol 2008;38(4)259–267.
- AH Poulsen, S Christensen, JK McLaughlin. Proton pump inhibitors and risk of gastric cancer: a population-based cohort study. British Journal of Cancer (2009) 100, 1503 – 1507.
- Toshitatsu Takao et al. Multifaceted Assessment of Chronic Gastritis: A Study of Correlations between Serological, Endoscopic, and Histological Diagnostics. Gastroenterol Res Pract. 2011; 2011:631461.
Источник
