Какие нпвп безопасны для желудка
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в 12-перстной кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает 3–5 раз, прободения — в 6 раз, риск смерти от осложнений до 8 раз. До 40–50% всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
- Кислота, которая по своему pH-балансу приближается к аккумуляторной кислоте
- Желчь и сок поджелудочной железы, которые могут забрасываться в желудок.
- Ряд лекарственных препаратов.
- Алкоголь и никотин.
- Раздражающие пищевые компоненты (специи, острая пища и т.д.)
- Инфекция Helicobacter pylori и так далее.
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и 12-перстной кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство

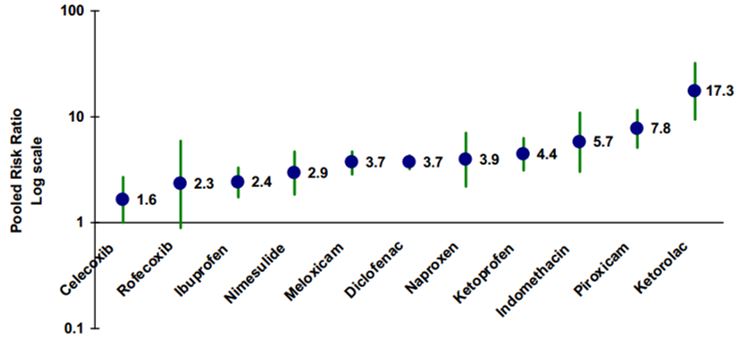
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в 2–3 раза. При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
- Перед длительным приемом НПВС обязательным является сбор анамнеза для исключения патологий ЖКТ в прошлом, по необходимости проведение гастроскопии, диагностика и лечение хеликобактериоза.
- Выбирая, чем лечиться, по возможности следует останавливаться на селективных НПВС.
- При назначении неселективных НПВС более 5 дней и у пациентов с эрозивно-язвенными изменениями в анамнезе даже с селективными НПВС обязателен прием препаратов «прикрывающих» желудок (ИПП).
- Всем пациентам в возрастной группе после 60 лет, регулярно принимающим аспирин, обязательно проводить гастроскопию и при высоких рисках принимать постоянно препараты из группы ИПП.
- Прием гастроэнтеролога в нашей клинике – 3 900 рублей
Источник
Десятки, а то и сотни миллионов людей ежегодно принимают препараты группы нестероидных противовоспалительных средств (НПВС, НПВП) не только для обезболивания или снижения повышенной температуры тела, но и для профилактики сердечно-сосудистых заболеваний или рака.
Одним из самых известных побочных эффектов, возникающих из-за приема НПВС, является поражение желудочно-кишечного тракта в общем, и язвенная болезнь в частности. В этой статье мы разберемся как нестероидные противовоспалительные средства поражают желудочно-кишечный тракт (ЖКТ) и как снизить вероятность этих осложнений (в отдельной статье).
НПВС и частота побочных эффектов со стороны желудочно-кишечного тракта
Поражение желудка и кишечника на фоне приема НПВС встречается достаточно часто:
- Поражение пищевода, включая эрозивный эзофагит, язвы пищевода, кровотечения, стриктуры: менее 1% случаев
- Диспепсия: 10 – 30% случаев
- Бессимптомное язвенное поражение: 10 – 15% случаев
- Симптоматические язвенное поражение, включая кровотечения и перфорации: 0,5 – 2% случаев
- Поражение кишечника: 1-5% случаев
- Поражение печени: 1-5% случаев
Приведем пример в абсолютных значениях: на каждые 1000 пациентов, принимающих аспирин для профилактики сердечнососудистых заболеваний, возникает от 2х до 33х случаев сильного желудочно-кишечного кровотечения вызванного аспирином в малой дозе за 3-10 лет наблюдений.
НПВС вызывают поражения ЖКТ разной степени выраженности. Эрозии чаще всего являются клинически незначимыми поражениям. Но интересно то, что даже язвенное поражение часто может протекать без очевидной симптоматики.
Но все же, основным и относительно частым побочным эффектом верхних отделов желудочно-кишечного тракта следует признать диспепсию, которая может встречаться в 30% случаев приема НПВС. Диспепсия – достаточно яркий симптомокомплекс, позволяющий предположить целый ряд проблем, но при обследовании не удается выявить объективные данные за поражение ЖКТ.
Как НПВС поражает желудочно-кишечный тракт?
Основная идея, известная широким массам, заключается в том, что НПВС (например, аспирин, т.е. ацетилсалициловая КИСЛОТА) поражает желудок прямым кислотным раздражением его стенки. Реальность несколько сложнее.
Желудочный сок содержит сильную соляную кислоту, которая обеспечивает как один из этапов переваривания пищи, так и защиту от микроорганизмов в пище. Соответственно, существует механизм защиты стенок желудка от пагубного воздействия соляной кислоты. Вот некоторые элементы этой защиты:
- Секреция гликопротеина (муцина) эпителиальными клетками
- Секреция бикарбоната эпителиальными клетками
- Секреция фосфолипидов эпителиальными клетками
- Улучшение кровотока через слизистые оболочки и доставку кислорода к эпителиальным клеткам
- Повышенная пролиферация эпителиальных клеток
Если говорить проще, между желудочным содержимым (включая соляную кислоту) и стенкой желудка формируется щелочная прослойка, не смешиваемая с желудочным соком. Этот механизм позволяет избегать контакта слизистой желудка с агрессивной желудочной средой.
Действительно, многие НПВС либо являются кислотами, либо имеют кислотную активность в растворенном состоянии. Но и в желудке ведь находится кислота. Является ли НПВС более сильной кислотой, чем желудочный сок?
Показатель, демонстрирующий силу кислоты, называется Ph (пи-аш), или водородный показатель. Чем меньше этот показатель, тем сильнее кислота. Шкала Ph от 0 до 14. Ph равный семи характеризует нейтральные соединения, например, воду. Все соединения c Ph ниже 7 характеризуются кислой средой своих растворов.
Для сравнения: Ph концентрированной серной кислоты равен 0,3, азотной кислоты 1, столового уксуса (не путать с уксусной эссенцией) 2,4 – 3. Ниже показатель кислотности некоторых продуктов питания:
- Ph вина 2,5-3,5
- Ph пива 4,5
- Ph лимонада 2,5-3,5
- Ph кока-колы 2,5
Ph желудочного сока, который содержит соляную кислоту, находится в диапазоне от 1 до 2. При этом показатель кислой среды желудка варьирует от 1,5 до 8. Т.е. в желудке может быть как очень кислая среда, так и щелочная. Таким образом, наш желудок адаптирован к гораздо более сильным кислотам, нежели НПВС.
Кислотность растворов НПВС колеблется в пределах 3,5-4,0. Как же тогда НПВС повреждает стенку желудка?
В повреждающем эффекте НПВС задействованы два механизма:
- Проникновение молекул НПВС в клетки желудка и их повреждение изнутри. Этот механизм имеет несущественное клиническое значение. Т.е. прямое нахождение НПВС в желудке несет незначительный риск повреждения желудочной стенки.
- НПВС повреждает механизм защиты желудка от кислот, т.е. повреждается щелочный слой, располагающийся между стенкой желудка и желудочным содержимым. Такое нарушение защиты связано с тем, что НПВС нарушает синтез простагландинов циклооксигеназ (ЦОГ-1 и ЦОГ-2), и в отсутствии защиты стенка желудка повреждается агрессивной средой желудочного содержимого.
Из этого следует один важный вывод: риск развития язвенного поражения желудка не зависит от пути введения НПВС. Т.е. не важно, пьете ли Вы таблетку диклофенака или препарат вводится внутримышечной инъекцией, риск нежелательных явлений одинаков. Подробнее об этом можно прочитать в статье “Внутримышечные инъекции. Боль во спасение или пережиток прошлого?”.
Как быстро НПВС повреждают желудок?
Для побочных эффектов НПВС прослеживается достаточно выраженная зависимость от дозы препаратов и длительности их приема. Чем дольше пациент принимает НПВС и чем выше доза, тем больше вероятность того, что возникнут нежелательные явления.
Нет известного времени или терапевтической дозы, назначение которых может привести к развитию побочных эффектов, но врачи исходят из следующей предпосылки: у пациента, с ранее здоровым желудочно-кишечным трактом, принимающего терапевтические дозы НПВС в течение недели и менее вероятность развития побочных эффектов близка к нулю, но не нулевая.
Примечательно, что большая часть нежелательных явлений при приеме НПВС возникает в первые три месяца лечения. В ряде исследований показано, что максимальный риск побочных эффектов НПВС фиксируется к 84 дню приема этой группы препаратов.
НПВС и желудочно-кишечный тракт. Факторы риска
У молодого пациента с изначально здоровым желудочно-кишечным трактом вероятность гастродуаденальной токсичности НПВС минимальна. Сопутствующие заболевания, принимаемые лекарственные средства, возраст – это факторы, увеличивающие риск развития побочных эффектов. Врачи в своей оценке ориентируются на следующие факторы риска:
- Возраст ≥60 лет
- Использование глюкокортикоидов
- Диспепсия или симптомы гастроэзофагеальной рефлюксной болезни
В 2009 году Американский кардиологический колледж (ACG) предложил учитывать следующие факторы риска:
- Язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе
- Возраст> 65 лет
- Высокие дозы НПВС
- Одновременный прием аспирина (включая низкие дозы), глюкокортикоидов или антикоагулянтов
Перечисленные факторы риска позволяют разделять пациентов на три группы:
- Пациенты высокого риска: наличие в анамнезе осложненной язвенной болезни или ≥3 факторов риска.
- Пациенты умеренного риска: наличие одного-двух факторов риска.
- Пациенты низкого риска: отсутствие факторов риска
НПВС и хеликобактер. Патология синергии
В контексте любых проблем с желудочно-кишечным трактом нельзя не рассмотреть влияние хеликобактер пилори. Хеликобактерная инфекция однозначно увеличивает вероятность развития побочных эффектов, связанных с верхним отделом ЖКТ. Но главный вопрос: “влияет ли эрадикация на снижение этой вероятности?” не имеет однозначного ответа. На сегодняшний день верным подходом видится следующий:
- Пациенты с пептической язвой желудка и/или двенадцатиперстной кишки в анамнезе должны быть проверены на хеликобактер пилори до начала курса НПВС или терапии низкими дозами аспирина. При наличии H. pylori следует провести соответствующую терапию, даже если считается, что предшествующая язва возникла из-за НПВС.
- У бессимптомных пациентов, у которых не было язв в анамнезе и которые в настоящее время не принимают НПВС, врачи могут рассмотреть возможность тестирования на H. pylori до начала длительной терапии НПВС.
Исследования показали, что эрадикация хеликобактер пилори была полезной у пациентов, которые не принимали НПВС, в то время как небольшая польза наблюдалась у пациентов, которые уже принимали и переносили НПВС. Такой подход «тест и лечение» может быть более полезным в группах населения с относительно высокой распространенностью хеликобактерной инфекции.
НПВС. Взаимодействие с другими препаратами
На вероятность побочных явлений НПВС влияют другие препараты. Здесь прежде всего следует упомянуть следующие группы препаратов:
- НПВС. Например, когда пациент, принимающий низкие дозы аспирина для профилактики заболеваний сердечно-сосудистой системы, начинает принимать другие НПВС для лечения боли.
- СИОЗС. Селективные ингибиторы обратного захвата серотонина, используемые в лечении депрессий и депрессивных расстройств, являются самостоятельным фактором риска желудочно-кишечных кровотечений. При сочетанном приеме СИОЗС и НПВС этот риск возрастает.
- Варфарин, НОАК и другие антикоагулянты. Сочетанный прием НПВС и антикоагулянтов существенно увеличивает риск желудочно-кишечных кровотечений. (Подробнее о варфарине)
- Другие антиагреганты, такие как клопидогрель, используемые в профилактике заболеваний сердечно-сосудистых заболеваний и осложнений.
Как снизить риск поражения желудочно-кишечного тракта при приеме НПВС мы обсуждаем в отдельной статье.
Источник
Статьи
Опубликовано в журнале:
Российский Гастроэнтерологический журнал »» № 2 2000 ЗАМЕТКИ И НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ Ю.В.Муравьев, А.В.Алексеева, Т.Н.Цапина
Институт ревматологии РАМН. Москва
- РЕЗЮМЕ
Приводятся доказательства важного значения соляной кислоты в возникновении НПВП гастропатий, обосновав практическое значение результатов суточного мониторирования внутрижелудочного рН в динамике и подтвердив его клиническими примерами возникновения повреждений слизистой оболочки верхних отделов желудочно-кишечного тракта, вызванных относящимся к “безопасным” НПВП ибупрофеном и нимесулидом у больных с такими факторами риска, как удлинение времени закисления более 360 мин в сутки и его дальнейшим увеличением в процессе терапии.
- SUMMARY
THE EFFECT OF NONSTEROID ANTI-INFLAMMATORY DRUGS (NSAID) ON THE GASTROINTESTINAL MUCOSA
Muraviev U.V., Aleksina A.V., Tchapina T.N.
Institute of Rheumatology, RAMS. Moscow
We have shown ificance of hydrochloric acid for NSAID’s gastropathies in this article. The important meaning of 24 hours monitoring of intragastric рН was demonstrated. All results were confirmed with clinical reports of upper gastrointestinal part mucosa damage. Gastropathies were induces with ibuprofen and nimesulid, so-called “safety” NSAID’s, in patients with such risk factors as extensions of sour more than 360 min/daily and its increasing during the treatment.
Более ста лет назад сформировалось представление о том, что наличие соляной кислоты в желудке является существенным фактором риска развития дуоденальной и желудочной язв [4].
Положение о том, что нестероидные противовоспалительные препараты (НПВП) способствуют повреждению слизистой оболочки желудочно-кишечного тракта (ЖКТ) стало достоянием гласности намного позже, после появления соответствующих эндоскопов [8]. Термин «НПВП гастропатия» предложен относительно недавно [23] для обозначения эндоскопически видимых повреждений слизистиой оболочки желудка (геморрагий, эрозий и язв), поскольку они имеют ряд отличий от классической пептической язвы. Предполагалось, что соляная кислота, основной фактор агрессии для развития пептических язвах, не имеет значения при НПВП гастропатиях, возникающих в результате подавления фермента циклооксигеназы (СОХ) и синтеза простагландинов (Pg). Сейчас уже хорошо известно, что СОХ преобразует арахидоновую кислоту в PgG2, а затем в PgH2, который в свою очередь преобразуется в физиологически активные Pg и тромбоксан. Первоначально предполагалось, что СОХ – это единый фермент, в дальнейшем было установлено, что он состоит из двух изоформ: СОХ-1 и СОХ-2, которые могут продуцировать PgH2. СОХ-1 определяется на довольно постоянном уровне в большинстве клеток, включая слизистую ЖКТ и тромбоциты. В слизистой оболочке ЖКТ СОХ-1 играет важную физиологическую роль: Pg, в частности PGE2, который является производным воздействия СОХ-1 на PGH2, предохраняет эпителиальный покров от изъязвления. Тромбоксан А2 – соответствующее производное в тромбоцитах, участвует в гемостатическом процессе. Уровень СОХ-2 во многих клетках незначителен, но может резко нарастать на фоне воспаления под влиянием цитокинов, митогенов и эндотоксинов, участвуя в продукции Pg, вовлеченных в процессы воспаления, митогенеза и клеточной пролиферации. Поскольку традиционные НПВП, включая аспирин, подавляют как СОХ-2, так и COX-1 [7], они уменьшают синтез Pg слизистой оболочкой ЖКТ (способствуя изъязвлению ЖКТ) и образование тромбоксана А2 тромбоцитами (способствуя кровотечению). Поэтому пациенты, длительно получающие традиционные НПВП, имеют больше кровотечений и других, обусловленных язвами осложнений, нежели те, кто их не получает [27]. Селективные ингибиторы СОХ-2 также, как ингибиторы СОХ-1 – СОХ-2, вызывают сходное уменьшение образования Pg, производных СОХ-2, продуцируемых в областях воспаления. При этом они также уменьшают риск образования язв ЖКТ и кровотечений. Таким образом, заболеваемость и смертность, связанные с применением традиционных НПВП могут быть уменьшены при назначении селективных ингибиторов СОХ-2, а профилактика язвообразования становится необязательной. Ряд контролируемых клинических испытаний позволяет считать, что селективное подавление СОХ-2 уменьшает воспаление суставов, боль и лихорадку. Однако, селективные ингибиторы СОХ-2 в терапевтических дозах подавляют также и СОХ-1 [7,12, 19]. Например, при назначении 100 мг/сут нимесулида (сильного ингибитора СОХ-2), в плазме создается концентрация препарата достаточно высокая для подавления СОХ-1, уменьшая таким образом образование тромбоксана [19]. Кроме того, в эксперименте показано, что ингибитор СОХ-2 – L-745, 337 снижает образование Pg in vitro в воспаленной ткани только в концентрации, которая также подавляет СОХ-1 [14]. В другом исследовании карагенин вводился в лапки крыс для того, чтобы вызвать воспаление. Самая низкая доза нимесулида или NS-398, уменьшавшая при этом воспаление, одновременно подавляла и активность СОХ-1, блокируя синтез Pg слизистой желудка [29] и вызывая ее повреждение. Кроме того, NS-398 не уменьшал карагениновое воспаление у крыс с дефицитом СОХ-2. Однако, индометацин, ингибирующий СОХ-1 и СОХ-2, уменьшал у них воспаление, по-видимому, за счет блокады СОХ-1. При отсутствии лечения вызываемое карагенином воспаление более медленно проходит у крыс с дефицитом СОХ-2, нежели у нормальных крыс; это позволяет думать, что СОХ-2 генерирует также и противовоспалительные Pg. Подобно тому, как производные СОХ-2: PgD2 и 15-деокси12-14PgJ2, продуцируемые моноцитами, постепенно оказывают противовоспалительное действие на плеврит, вызываемый карагенином [11].
Имеются данные, позволяющие думать, что СОХ-2 также, как СОХ-1, может присутствовать в нормальной слизистой желудка [15,30], хотя не все исследователи это подтверждают [17]. Если СОХ-2 действительно определяется в нормальной слизистой оболочке желудка, то это указывает на ее физиологическую роль. Например, когда неизмененная слизистая оболочка желудка крыс подвергается воздействию умеренных желудочных раздражителей (разведенный спирт), она адаптируется (в результате повышенного синтеза эндогенных Pg) к повреждающему действию более сильных раздражителей – таких, как абсолютный спирт [22]. У животных селективные ингибиторы СОХ-2, а также традиционные ингибиторы СОХ-1 и СОХ-2, в частности, индометацин аннулируют это защитное действие; результаты, позволяющие думать, что производные СОХ-2 Pg играют решающую роль в защитных реакциях слизистой оболочки желудка [13]. Другие экспериментальные данные также указывают на то, что Pg, производные СОХ-2, могут иметь важное значение в заживлении язв желудка [18, 26, 28], поскольку ряд ингибиторов СОХ-2 и некоторые традиционные НПВП (индометацин), замедляют их заживление. Однако, пока не совсем ясно как эти наблюдения могут быть перенесены на людей.
Клинические испытания нимесулида при остеоартрите показали, что он сопоставим с традиционными НПВП не только по эффективности, но и по частоте желудочно-кишечных побочных действий [9, 20]. Так, в 4-х недельном двойном слепом сравнительном испытании при эндоскопическом обследовании обнаружены язвы у трех больных (7%), получавших диклофенак натрия и у одного больного (2%), принимавшем нимесулид (различие недостоверно). В этом же исследовании эндоскопически видимые эрозии обнаружены у четырех больных, получавших нимесулид и у двух – диклофенак натрия (различие недостоверно). Проведенный анализ клинических испытаний нимесулида у тысяч больных показал, что препарат только не на много уменьшает частоту желудочно-кишечных побочных эффектов[9].
Специальная оценка наиболее часто применяемых традиционных НПВП показала, что наиболее безопасным в отношении слизистой оболочки ЖКТ является ибупрофен в дозе 1200 мг/сут и меньше, однако это различие исчезает при назначении более высоких доз препарата [10].
Для уточнения влияния внутрижелудочного рН на тяжесть повреждений слизистой желудка, вызываемых НПВП, была проведена специальная экспериментальная работа [24]. В течение 3-х часов в желудке крыс разных групп поддерживалась рН 1,7/ 1,8 или 3,7, в этот период времени им внутривенно вводили аспирин или солевой раствор (контроль). Оказалось, что в группе крыс с желудочным рН 1,7 аспирин вызывал появление геморрагий слизистой желудка в 100%, в то время как при рН 3,7 никаких повреждений не наблюдалось. Внутривенное введение солевого раствора при желудочном рН 1,8 способствовало появлению геморрагий слизистой желудка в 1 8%. Эти данные демонстрируют, что внутрижелудочный рН имеет определяющее значение в повреждении слизистой оболочки желудка.
Рядом авторов установлено, что Pg обладают антисекреторным действием, проявляющимся угнетением выработки соляной кислоты [2, 3, б]. Однако, при назначении НПВП получены неоднородные результаты. Так, одни авторы [25] обнаружили, что у больных ревматоидным артритом (РА) имеется усиление кислотообразования (по сравнению со здоровыми), нарастающее под влиянием индометацина и кетопрофена. Другие установили, что индометацин не влиял на кислотообразование как у больных РА [1б], так и у здоровых [21]. Проведенное в Институте ревматологии суточное мониторирование внутрижелудочного рН показало, что в период отмены НПВП у 70% больных РА без гастропатий регистрируется удлинение времени закисления более 360 мин [I]. Такой показатель можно считать фактором риска возникновения в последующем повреждений слизистой желудка, поскольку мета-анализ 300 работ позволил установить, что язвы рубцуются в 100% случаев при внутрижелудочном рН >3,0, поддерживаемом не менее 18 часов [5]. Эти положения подтверждены и нашими данными, поскольку у больных РА с НПВП гастропатиями происходит заметное (р<0,09) удлинение времени закисления (по сравнению с больными РА без гастропатий) с одновременным снижением ощелачивающей функции желудка (р<0,03). Назначение больным РА без гастропатий индометацина и диклофенака натрия приводит к усилению кислотообразующей функции соответственно в 70% и в 20% случаев [1].
Мы не располагаем литературными данными о влиянии считающегося самым безопасным из традиционных НПВП для ЖКТ – ибупрофена – на функциональное состояние желудка. Однако, наблюдали случай развития язвы луковицы двенадцатиперстной кишки на фоне приема «безопасной» (1200 мгсут) дозы ибупрофена у больной с гиперацидным состоянием.
Больная Б., 46 лет, госпитализирована в клинику Института ревматологии РАМН в феврале 2000 года с диагнозом: Ревматоидный артрит (серонегативный): полиартрит, активность 2, стадия 1, функциональная недостаточность суставов 1 степени. При поступлении предъявляла жалобы на боли и припухлость мелких суставов кистей, лучезапястных, правого плечевого суставов, скованность в суставах по утрам в течение 3х часов, слабость, ограничение объема движений в лучезапястных, плечевых суставах. Из анамнеза известно, что больна в течение Зх месяцев, когда после перенесенной пневмонии появились артриты суставов кистей, при лабораторном обследовании выявлено ускорение СОЭ до 53 ммч. По месту жительства назначен индометацин 75 мгсут, затем ибупрофен 1200 мгсут, который принимала в течение 2х месяцев, предшествовавших госпитализации, дополнительно был назначен делагил 250 мгсут в течение 1,5 месяцев. В 1994 году при ЭГДС была выявлена язва луковицы двенадцатиперстной кишки, по поводу которой принимала ранитидин. В дальнейшем периодически возникали сезонные боли в эпигастрии, в эти периоды самостоятельно принимала несколько таблеток ранитидина, ЭГДС не проводилась. При лабораторном обследовании в стационаре выявлено ускорение СОЭ до 25 ммч, СРБ 1,5 мг%, латекс 120. На фоне отсутствия жалоб со стороны ЖКТ на третий день пребывания в стационаре выполнена диагностическая ЭГДС и выявлены гиперемия и отечность слизистой антрума, множественные плоские эрозии до 0,2 мм, покрытые фибрином, луковица двенадцатиперстной кишки деформирована, слизистая ее гиперемирована, отечна, видны множественные плоские эрозии до 0,2 мм покрытые фибрином. В день проведения ЭГДС при суточной рН-метрии на фоне отмены препаратов выявлено в теле желудка гиперацидность, непрерывное кислотообразование, средний рН за сутки 0,6, удлинение времени закисления до 1040 минут. В дальнейшем был назначен нимесулид 200 мгсут, омепразол 40 мгсут. Через 10 дней при повторной ЭГДС отмечалась эпитализация эрозий желудка, сохранение 3-4 эрозий в луковице двенадцатиперстной кишки.
В литературе пока нет сообщений о влиянии селективных НПВП, в частности, нимесулида, на функциональное состояние желудка. Мы наблюдали возникновение язвы у больной с нормацидным состоянием, но удлинением времени закисления желудка на фоне лечения нимесулидом.
Больная Д., 52 лет, находилась в клинике Института ревматологии РАМН с диагнозом: Остеоартроз, безузелковая форма. Гонартроз 2 стадии по Келгрену. Поступила с жалобами на боли в коленных, тазобедренных, мелких суставах кистей, усиливающиеся к вечеру и при физической нагрузке, на ограничение объема движений в левом плечевом суставе. Боли в суставах беспокоят около 2х лет, купировались после однократных приемов 25 мг ортофена, мазевых аппликаций НПВП. Из анамнеза: в 1985 году при ЭГДС выявлена язва луковицы двенадцатиперстной кишки, по поводу обострения которой в дальнейшем проводились неоднократные госпитализации и терапия антисекреторными препаратами (ранитидином, омезом). Последние 3 года отмечались сезонные боли в околопупочной области, ЭГДС не проводилась, в эти периоды самостоятельно принимала омез. В ноябре 1999 года принимала нимесулид с хорошим обезболивающим эффектом, одновременно принимала энап 50 мг, аспирин 250 мг в связи с подозрением на ишемическую болезнь сердца и повышение артериального давления, которые в дальнейшем не подтвердились. Однако, на фоне терапии этими препаратами появились боли в эпигастрии. Энап и аспирин были отменены и проведена терапия омезом в течение 7 дней на фоне продолжающегося приема 100 мгсут нимесулида. Гастралгии прошли, прием препаратов прекратился. С декабря 1999 года никаких лекарств не принимает. При лабораторном обследовании ускорения СОЭ нет, ревматоидный фактор отрицательный. Учитывая язвенный анамнез и необходимость терапии НПВП на третий день госпитализации была проведена ЭГДС. Выявлены: гиперемия и отек антрального отдела, деформация луковицы двенадцатиперстной кишки, на верхней стенке – линейный «белый рубец» 0,8 см, позволяющий говорить о том, что рубцевание язвенного дефекта произошло несколько месяцев назад. При проведении суточной рН-метрии на фоне отмены препаратов в теле желудка выявлено нормацидность, непрерывное кислотообразование, средний рН за сутки 2,0, а также удлинение времени закисления до 780 минут; в антруме – декомпенсация ощелачивания, средний рН за сутки 2,6. Учитывая наличие суставного синдрома, язвенный анамнез, данные ЭГДС и прогностические показатели рН-метрии был назначен селективный НПВП – нимесулид 100 мгсут. На 4-ый день приема препарата больная отметила небольшие боли в эпигастрии, тошноту, однократный жидкий стул. При повторной суточной рН-метрии на фоне терапии нимесулид ом выявлено: в теле желудка гиперацидность, непрерывное кислотообразование, средний рН за сутки 1,5, удлинение времени закисления до 840 минут; в антруме – декомпенсация ощелачивания, средний рН за сутки 2,0. При повторной ЭГДС выявлены отек и гиперемия слизистой антрума, отек и гиперемия слизистой луковицы 12 п.к., на верхней стенке – неглубокая язва 0,7 см. Нимесулид отменен, назначен омепразол 20 мгсут. На 3-ий день исчезли «голодные» боли в эпигастрии, однако стала отмечать появление ноющих, тупых болей в правом подреберье, периодически изжогу, которые сохранялись в течение недели и уменьшились на фоне внутримышечных инъекций но-шпы. При выполнении УЗИ внутренних органов отмечено только наличие перегиба в шейке желчного пузыря, небольшое повышение эхоплотности поджелудочной железы. При лабораторном обследовании: в моче уровень амилазы в пределах нормы, в биохимическом анализе крови нормальные печеночные пробы, билирубин. Повторная ЭГДС через 8 дней выявила появление “красного рубца”.
Таким образом, у больной с язвенным анамнезом на фоне недельной терапии нимесулидом (всего 600 мг – 6 таблеток) возникла язва двенадцатиперстной кишки, что, по-видимому, связано с усилением кислотообразующей функции желудка на фоне декомпенсации ощелачивания.
Таким образом, важное прогностическое значение для оценки риска возникновения эрозивно-язвенных изменений слизистой оболочки ЖКТ даже при назначении “безопасных” НПВП (в том числе и селективных) имеют исходные показатели суточного мониторирования внутрижелудочного рН, что и подтверждают приведенные выше клинические примеры.
Литература
1. Алексеева А.В. Влияние диклофенака натрия и индометацина на показатели суточного мониторирования желудочной секреции у больных ревматоидным артритом. Дисс.канд.мед., М., 1999,139 с.
2. Гребенев А.Л., Шептулин А.А. Эффективность применения сайтотека при лечении язвенной болезни. Медикал Маркет, 1996, № 22, с.53.
3. Дауни У. Роль препарата мизопростол в лечении гастропатий, вызываемых нестероидными противовоспалительными препаратами. Клин. ревматология, 1992, №4, с.40-43.
4. Ивашкин В.Т. Соляная кислота и кислотозависимые заболевания. Русский мед.журнал, 1995, т.2, №1, с. 24-32.
5. Burget D.W., Chiverton K.D., Hunt R.H. Is there an optimal degree of acid suppression for healing of duodenal ulcers? A model of the relationship between ulcer healing and acid suppression. Gastroenterology, 1990, v. 99, p. 345-351.
6. Cohen M.M. Role of endogenous prostaglandins in gastric secretion and mucosal defence. Clin.Invest.Med., 1987, v.10., p.226-231.
7. Cryer В., Feldman М. Cyclooxygenase-1 and cyclooxygenase-2 selectively of widely used nonsteroidal anti-inflammatory drugs.Am.J.Med.,1998,v.l04,p.413-421.
8. Douthwaite A.H., Lintott S.A.M. Gastroscopic observation of the effect of aspirin and certain other substances on the stomach. Lancet, 1938, v.2, p. 1222-1225.
9. Feldman M., Alexander T. Do cyclooxygenase-2 inhibitors provide benefits similar to those of traditional nonsteroidal anti-inflammatory drugs, with less gastrointestinal toxicity? An.Intem.Med., 2000, v.132, p.134-143.
10. Garcia Rodriguez L.A. Variability in risk of gastrointestinal complications with different nonsteroidal anti-inflammatory drugs. Am.J.Med., 1998, v.104, p.30-34.
11. Girloy D.W., Colville-Nash P.R., Willis D. et al. Inducible cyclooxygenase may have anti-inflammatory properties. Nat.Med., 1999, v.5, p.698-701.
12. Glaser K., Sung M.L., O’Neill K. Et al. Etodolac selectively inhibits human prostaglandin G/H synthase 2 (PGHS-2) versus human PGHS-1. Eur.J.PharmacoL, 1995, v.281, p. 107-111.
13. Gretzer В., Ehrlich K., Maricic N. et al. Selective cyclo-oxygenase-2 inhibitors and their influence on the protective effect of a mild irritant in the rat stomach. Br.J.Pharmacol., 1998, v.123, p.927-935.
14. Gretzer В., Knorth H., Chantrain M. et al. Effects of diclofenac and L-745,337, a selective cyclooxygenase-2 inhibitor on prostaglandin E2 formation in tissue from human colonic mucosa and chronic bursitis [Abstract]. Gastroenterology, 1998, v.ll4,A139.
15. Iseki S. Immunocytochemical localization of cyclooxygenase-1 and cyclooxygenase-2 in the rat stomach. Histochem.J., 1995, v.27, p.323-328.
16. Janssen M., Baak L.C., Jansen J.B., et al. Effect of indocin on intragastric pH and meal-stimulated serum gastrin secretion in rheumatoid arthritis patients.-Pharmacol.Ther., 1993, v.4, p.393-400.
17. Kargman S., Charleson S., Cartwright M. et al. Characterization of prostaglandin G/H synthase 1 and
