Как происходит активация протеолитических ферментов желудка и кишечника
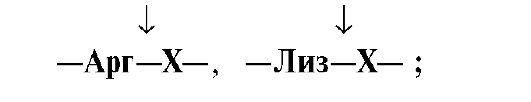
единица1 | 9.1. Рольбелков в питании. Азотистый баланс 9.2. Перевариваниебелков в желудке и кишечнике, всасываниеаминокислот 9.3. Трансаминированиеи дезаминирование аминокислот |
Модульнаяединица 2 | 9.4. Обменаммиака: источники, превращение втканях 9.5. Орнитиновыйцикл и его биологическая роль 9.6. Гипераммониемияи ее причины 9.7. Путииспользования безазотистых остатковаминокислот 9.8. Биосинтеззаменимых аминокислот |
Модульнаяединица 3 | 9.9. Обменсерина и глицина. Роль фолиевой кислоты 9.10. Обменметионина. Реакции трансметилирования 9.11. Обменфенилаланина, тирозина и гистидинав разных тканях 9.12. Заболевания,связанные с нарушением обменафенилаланина и тирозина 9.13. Биогенныеамины: синтез, инактивация, биологическаяроль |
ЕМА 9.1. РОЛЬБЕЛКОВ В ПИТАНИИ. АЗОТИСТЫЙ БАЛАНС
В организмечеловека содержится примерно 15 кгбелков. Количество свободных аминокислотсоставляет около 35 г. Ежесуточно ворганизме распадается до аминокислотпочти 400 г белков и столько же синтезируется.
1. Основнымисточником аминокислот для человекаявляются пищевые белки. Суточная нормапотребления белков составляет в среднемоколо 100 г.
20 α-аминокислот,которые встречаются в белках организма,можно разделить на четыре группы:
• заменимыеаминокислоты – Ала, Асп, Асн, Глу, Глн,Про, Гли, Сер -синтезируются в необходимых количествахв организме;
• незаменимыеаминокислоты – Вал, Лей, Иле, Мет, Фен,Три, Лиз, Тре -не могут синтезироваться в организмеи должны поступать с пищей;
• частичнозаменимые аминокислоты – Гис, Арг -синтезируются очень медленно, вколичествах, не покрывающих потребностиорганизма, особенно в детском возрасте;
• условнозаменимые аминокислоты – Цис, Тир -синтезируются из незаменимых аминокислотМет и Фен соответственно.
2. Полноценностьбелкового питания зависитот аминокислотного состава белков иопределяется наличием незаменимыхаминокислот.Отсутствиев пищевых белках незаменимых аминокислот(даже одной) нарушает их синтез ворганизме. Обновление белков в различныхтканях происходит с разной скоростью.Так, белок соединительной ткани коллагенобновляется полностью за 300 дней, абелки системы свертывания крови – отнескольких минут до нескольких дней.
3. Большаячасть свободных аминокислот используетсядля синтеза собственных белков организма.Кроме того, из аминокислот синтезируетсябольшое количество биологическиактивных молекул:
• биогенныеамины (медиаторы); некоторые аминокислотысами являются нейромедиаторами -например, глицин и глутамат;
• гормоныбелковой природы;
• гем,креатин, карнитин и другие азотсодержащиесоединения.
Аминокислотыподвергаются реакции дезаминирования;образовавшиеся безазотистые остаткииспользуются для синтеза глюкозы,кетоновых тел или окисляются до СО2 иН2О.
Азот аминокислотвыводится из организма почками в видемочевины или аммонийных солей.Аминокислоты и белки содержат до 95%всего азота организма.
4. Азотистыйбаланс -разница между количеством азота,поступающего с пищей, и количествомазота, выделяемого почками в видемочевины и азотистых солей. Он являетсяпоказателем состояния белкового иаминокислотного обмена.
Азотистыйбаланс можетбыть:
• положительным -у детей, беременных женщин, при увеличениимышечной массы у спортсменов и больных,выздоравливающих после тяжелой болезни,что свидетельствует о преобладаниисинтеза белков и роста тканей над ихраспадом;
• отрицательным -при тяжелых заболеваниях, голодании,старении, что свидетельствует обусилении процессов распада белков;
• равнымнулю (азотистое равновесие) – уздоровых взрослых людей при нормальномпитании.
1. Припереваривании происходит гидролизпищевых белков до свободных аминокислот.Процесс переваривания начинается вжелудке и продолжается в тонком кишечникепод действием ферментов пептидгидролаз(пептидаз). Основныепептидазы синтезируются в клеткахжелудка, поджелудочной железы и кишечника(рис. 9.1). В желудке белкипищи денатурируются и гидролизуютсяс образованием олигопептидов.Вкишечнике панкреатическиепептидазы продолжают гидролизолигопептидов до ди- и трипептидов исвободных аминокислот. Короткие пептидырасщепляются до свободных аминокислотв пристеночномслое илив клетках кишечного эпителия. Затемпроисходит их всасывание.
Все пептидазы, взависимости от места расположения впептиде гидролизуемой связи, делятсянаэндопептидазы и экзопептидазы:
• эндопептидазы -расщепляют пептидные связи, удаленныеот концов пептидной цепи (пепсин,трипсин, химотрипсин, эластаза);
• экзопептидазы- гидролизуютпептидные связи, образованные N- иС-концевыми аминокислотами (аминопептидаза,карбоксипептидазы А и В),а также расщепляют ди- и трипептиды.
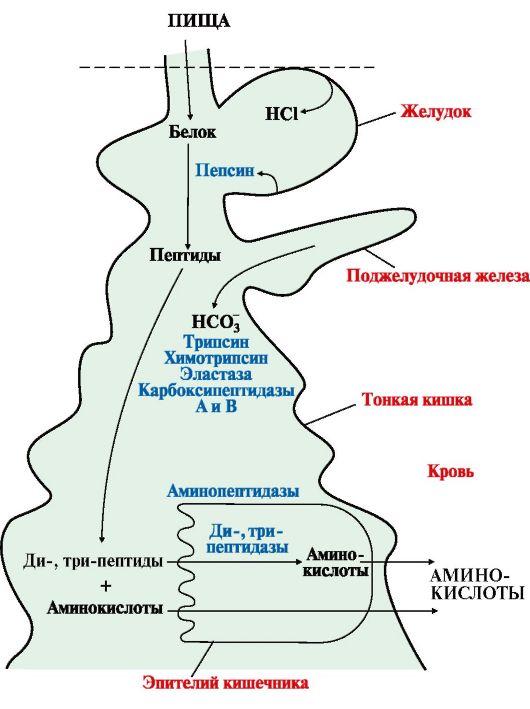 Рис.9.1. Переваривание белков в желудочно-кишечномтракте
Рис.9.1. Переваривание белков в желудочно-кишечномтракте
Ферменты,участвующие в переваривании белков,обладают относительной субстратнойспецифичностью и гидролизуют пептидныесвязи; при этом каждая пептидазапреимущественно расщепляет связи,образованные определенными аминокислотами(табл. 9.1).
2. Желудочныеи панкреатические пептидазы вырабатываютсяв неактивной форме (проферменты), секретируютсяк месту действия, где активируются путемчастичного протеолиза (отщеплениепептида различной длины, чаще с N-концамолекулы профермента). Местосинтеза проферментов (клеткислизистой оболочки желудка, поджелудочнаяжелеза) и местоих активации (полостьжелудка, тонкого кишечника)пространственноразделены. Такоймеханизм образования активных ферментовнеобходим для защиты секреторных клетокжелудка и поджелудочной железы отсамопереваривания.
Таблица9.1. Характеристика протеолитическихферментов желудочно-кишечного тракта
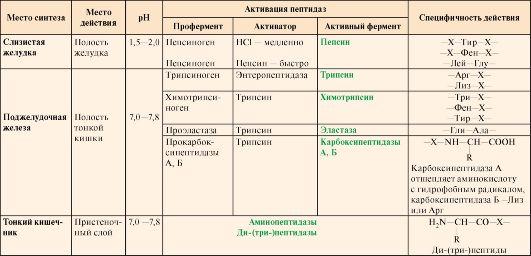 Примечание: X- любая аминокислота
Примечание: X- любая аминокислота
Преждевременнаяактивация проферментов в секреторныхклетках происходит при:
• язвеннойболезни желудка -пепсиноген превращается в пепсин вклетках слизистой желудка;
• остромпанкреатите -трипсиноген превращается в трипсин вклетках поджелудочной железы и активируетостальные панкреатические пептидазы.
3. Слизистаяоболочка желудка вырабатывает следующиефакторы, необходимые для перевариваниябелков:
• пепсиноген -синтезируется в главных клетках;
• солянуюкислоту -вырабатывается обкладочными клетками.Гидролиз белков вжелудке происходитпод действием пепсина.
Проферментпепсиноген при поступлении пищисекретируется в полость желудка, гдев два этапа происходит его активация:
• с помощьюНС! – медленно;
• аутокаталитически- быстро, уже имеющимся пепсином. Солянаякислота желудочногосока выполняет следующие функции:
• .участвуетв активации пепсиногена;
• создаетоптимум рН для пепсина;
• оказываетбактерицидное действие;
• денатурируетбелки пищи.
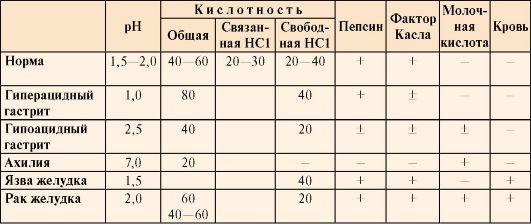
Значение рНжелудочного сока в норме составляет1,5-2,0. Определениекислотности желудочного сока используетсядля диагностики различных заболеванийжелудка (табл. 9.2).
Таблица9.2. Компоненты желудочного сока в нормеи при патологических состояниях
•  Общаякислотность желудочного сока -это совокупность всех кислотореагирующихвеществ желудочного сока, представляющаясобой секрет желудка, собираемый втечение 1 часа (предварительно отбираютсекрет, ранее содержащийся в желудке).
Общаякислотность желудочного сока -это совокупность всех кислотореагирующихвеществ желудочного сока, представляющаясобой секрет желудка, собираемый втечение 1 часа (предварительно отбираютсекрет, ранее содержащийся в желудке).
• Связаннаясоляная кислота -это соляная кислота, связанная с белкамии продуктами их переваривания.
• Свободнаясоляная кислота -это соляная кислота, не связанная сдругими молекулами.
• Общаякислотность желудочного сока выражаетсяв титрационных единицах (ТЕ) иизмеряется количеством 0,1 М NaOH вмиллилитрах, затраченным на титрование100 мл желудочного сока в присутствииопределенных индикаторов.
• Кислотностьжелудочного сока внорме составляет:
общая 40-60 ТЕ;
связаннаяHCl 20-30 ТЕ;
свободнаяHCl 20-40 ТЕ.
При диагностикезаболеваний желудка помимо биохимическиханализов обязательно проводятрентгенологические и эндоскопическиеисследования, иногда биопсию.
В слизистойоболочке желудка вырабатываетсятакже внутреннийфактор (фактор Касла), которыйпредставляет собой белок, способствующийвсасыванию витамина В12 втонкой кишке. Отсутствие этого витаминачасто приводит к развитию анемии.
Молочнаякислота внорме в желудочном соке отсутствует.Образуется при уменьшении содержанияили отсутствии свободной солянойкислоты в результате усиленногоразмножения молочнокислых бактерийили при злокачественных опухоляхжелудка.
НС1 и пепсинспособны разрушать клетки эпителияжелудка. В норме это не происходитблагодаря наличию защитных факторовслизистой оболочки, таких, как:
• образованиена поверхности слизи, содержащейгетерополисахариды, которые не являютсясубстратами пептидгидролаз;
• секрецияэпителиальными клетками ионов НСО3-,создающих в пристеночном слое менееагрессивную среду с рН 5,0-6,0, в которойпепсин неактивен. Кроме того, клеткиповрежденного эпителия обладаютспособностью к быстрой регенерации.
Пепсингидролизует пептидныесвязи, образованные аминогруппой иликарбоксильной группой ароматическихаминокислот (см. табл. 9.1):
4.Переваривание белков в кишечнике происходитпод действием:
• ферментовподжелудочной железы-трипсина,химотрипсина, эластазы, карбоксипептидазА и Б;
• ферментовэпителия тонкой кишки – аминопептидазы,дипептидаз, трипептидаз.
Активнаяформа трипсина образуетсяв кишечнике при участии ферментаэнтеропептидазы, выделяемого клеткамикишечника. Энтеропептидазаотщепляетот N-конца трипсиногена гексапептид(рис. 9.2), что приводит к изменениюконформации молекулы и формированиюактивного центра трипсина.
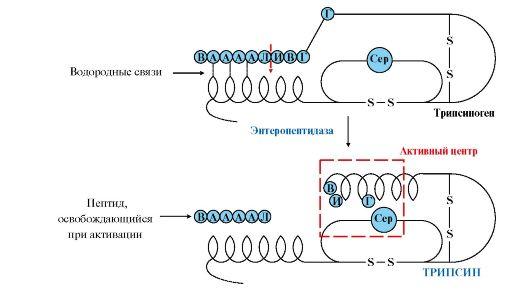 Рис.9.2. Механизм активации трипсиногена.
Рис.9.2. Механизм активации трипсиногена.
Пунктирнаястрелка – место гидролиза. Буквамиобозначены аминокислоты (А – асп, Г -глу, В – вал, Л – лиз, И – иле)
Остальные проферментыпанкреатического сока (химотрипсиноген,прокарбоксипептидазы А и В, проэластаза)активируются трипсином.Активацияпанкреатических пептидаз в кишечникепроисходит в виде каскада реакций.
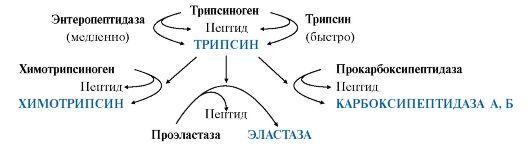 Ферментыэпителия тонкой кишки синтезируютсяв энтероцитах сразу вактивной форме.
Ферментыэпителия тонкой кишки синтезируютсяв энтероцитах сразу вактивной форме.
• Ферменты,участвующие в переваривании белков вкишечнике, обладаютсубстратной специфичностью копределенным аминокислотам вбелке: Трипсин гидролизуетпреимущественно пептидные связи,образованные карбоксильными группамикатионогенных аминокислот:
• 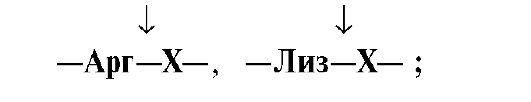 Химотрипсин -пептидные связи, образованныекарбоксильными группами ароматическихаминокислот:
Химотрипсин -пептидные связи, образованныекарбоксильными группами ароматическихаминокислот:
• Эластаза -связь между -Гли-Ала-
• Карбоксипептидазы отщепляютС-концевые аминокислоты:
карбоксипептидаза А -гидрофобные аминокислоты, карбоксипептидаза В- Лиз и Арг;
• Аминопептидаза -отщепляет N-концевые аминокислоты;
• Дипептидаза -гидролизует дипептиды;
• Трипептидаза -расщепляет трипептиды на отдельныеаминокислоты.
5. Конечнымрезультатом переваривания белковявляется образование свободныхаминокислот, поступающих в клеткислизистой оболочки кишечника,путем вторично-активноготранспорта засчет градиента концентрации натрия(симпорт). Всасывание L-аминокислотявляется активным, требующим затратыэнергии процессом. Транспорт ихосуществляется двумя путями:
• черезворотную систему печени;
• полимфатическим сосудам, сообщающимсяс кровью через грудной лимфатическийпроток.
Аминокислотыконкурируют друг с другом за специфическиеучастки связывания белков-переносчиков.Так, всасывание лейцина в большихколичествах уменьшает всасываниеизолейцина и валина. В крови максимальнаяконцентрация аминокислот достигаетсячерез 30-50 минут после приема белковойпищи. Свободные аминокислоты, в отличиеот белков пищи, лишены видовойспецифичности и не обладают антигеннымисвойствами.
Скоростьпроникновения аминокислот черезмембраны клеток различается, чтоуказывает на существование транспортныхсистем, обеспечивающих переносаминокислот через мембраны. Известнопять специфических транспортных системдля переноса определенной группыблизких по строению аминокислот:
• нейтральныхс короткой боковой цепью (аланин,серин, треонин);
• нейтральныхс длинной или разветвленной боковойцепью (валин,лейцин, изолейцин);
• скатионными радикалами (лизин,аргинин);
• санионными радикалами (глутаминоваяи аспарагиновая кислоты);
• иминокислот (пролин,оксипролин).
Переносчикиаминокислот первой и пятой групп, атакже переносчик метионина относятсяк числу Na+-зависимых. Независимые отNa+ переносчики специфичны для некоторыхнейтральных аминокислот (фенилаланин,лейцин) и аминокислот с катионнымирадикалами (лизин).
Одной изосновных транспортных систем длянейтральных аминокислотявляется γ-глутамильныйцикл, которыйфункционирует в почках, поджелудочнойжелезе, печени и селезенке, в мозге идругих тканях он содержится в оченьнебольших количествах (рис. 9.3).
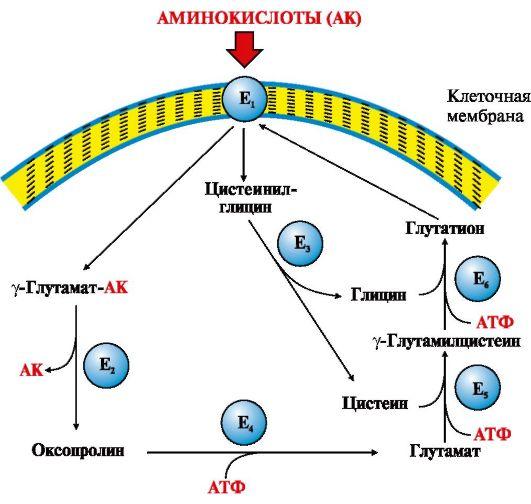 Рис.9.3. γ-Глутамильный цикл:
Рис.9.3. γ-Глутамильный цикл:
Е1 -γ-глутамилтранспептидаза (γ-ГТ); Е2 -γ-глутамилциклотрансфераза; Е3 -пептидаза; Е4 -оксопролиназа; Е5 -γ-глутамилцистеинсинтетаза; Е6 -глутатионсинтетаза.
Системасостоит из одного мембранного и пятицитоплазматических ферментов. Переносаминокислоты внутрь клетки осуществляетсяв комплексе с глутамильным остаткомглутатиона под действием ферментаγ-ГТ. Затем аминокислота освобождается,а γ-глутамильный остаток в несколькостадий превращается в глутатион, которыйспособен присоединять следующуюмолекулу аминокислоты
Ключевуюроль в работе системы играет мембранныйфермент γ-глутамилтранспептидаза(γ-ГТ). Этотгликопротеин катализирует переносγ-глутамильной группы сглутатиона (γ-глутамилцистеинилглицин)или другого γ-глутамильного пептидана транспортируемую аминокислоту ипоследующий перенос комплекса в клетку.Глутатион содержится во всех тканяхживотных. Для транспорта в клетку одноймолекулы аминокислоты с участиемγ-глутамильного цикла затрачиваетсятри молекулы АТР.
γ-ГТ в большихколичествах содержится в почках,поджелудочной железе, печени и другихтканях. Активность фермента в сывороткекрови в норме составляет 30-50 МЕ/л(мкмоль/мин-мг) для мужчин и 25-35 МЕ/л дляженщин. Определение активности γ-ГТ всыворотке крови используется длядиагностики заболеваний печени исердца. γ-ГТ-тест используется также вкачестве маркера рака поджелудочнойжелезы, печени, предстательной железыи для обнаружения людей из группыраннего риска алкоголизма, для контроляза лечением хронического алкоголизма.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
162. Протеолитические ферменты пищеварительного тракта, проферменты, их активация.
Белки, поступающие в желудок, стимулируют
выделение гистамина и группы белковых
гормонов – гастринов. Они вызывают
секрецию соляной кислоты и профермента
– пепсиногена.
Механизм активации пепсина. Пепсиноген
– неактивная форма пепсина. Пепсиноген
– белок, состоящий из одной полипептидной
цепи. Под действием соляной кислоты он
превращается в активный пепсин. В
процессе активации в результате
протеолиза от N-конца молекулы пепсиногена
отщепляются 42 аминокислотных остатка.
В поджелудочной железе синтезируются
проферменты: трипсиноген, хемотрипсиноген,
проэластаза, прокарбоксипептидазы А и
В.
Активация трепсиногена происходит под
действием энтеропептидазы. Происходит
изменение конформации, что ведет к
формированию активного цента, и образуется
активный трепсин.
Трипсин активирует хемотрепсиноген.
Он состоит из полипептидной цепи. Под
действием трипсина расщепляется
пептидная связь между 15 и 16 аминокислотами,
и образуется активный хемотрипсин.
Остальные ферменты (проэлазастаза и
прокарбоксипептидаза А и В) также
активируются трипсином путем частичного
протеолиза. В результате образуются
акттивные ферменты – эластаза и
карбоксипептидаза А и В.
Карбоксипептидазы А и В – цинкосодержащие
ферменты, отщепляют С-концевые остатки
аминокислот. Карбоксипептидаза А
отщепляет ароматические и гидрофобные
радикалы, а карбоксипептидаза В –
остатки аргинина и лизина.
Конечный результат действия протеолитических
ферментов желудка и кишечника –
расщепление пищевых белков до свободных
аминокислот.
163. Реакции дезаминирования, переаминирования, непрямого дезаминирования и восстановительного аминирования. Схемы процессов, ферменты, значение.
Аминокислоты, образующиеся при
переваривании белков и поступающие в
клетки тканей, подвергаются катаболизму
и анаболизму, а также специфическим
реакциям с образованием биологически
активных веществ (БАВ).
Трансаминирование.
Реакция переноса аминогруппы с
аминокислоты на альфа-кетокислоту с
образованием новой кетокислоты и
аминокислоты. Реакции катализируют
пиридоксальфосфат-зависимые ферменты
(витамин В6). Обнаружено около 10
аминонтрансфераз имеющих локализацию
как в цитозоле, так и митохондриях. В
реакции переаминирования могут вступать
все аминокислоты, за исключением лизина,
треонина, пролина.
Аминотрансферазы – ферменты, осуществляющие
перенос аминогруппы. Активная форма
образована присоединением пиридоксальфосфата
к аминокислоте лизину, который находится
в составе аминотрансферазы с помощью
прочной альмидиновой связи.
Органоспецифичные аминотрансферазы
АСТ и АЛТ.
Трансаминированию в тканях подвергаются
наиболее распространенные аминокислоты,
такие как – аланин, глутамат, аспартат
и соответсвующие им акцепторы аминогрупп
– пируват, альфа-кетоглутарат,
оксалоацетат.
Аминотрансферазы обладают субстратной
специфичностью, наиболее распространены
аланинаминотрансфераза (АЛТ), катализирующий
обратно данную реакцию
глутаматпируватаминотрансфераза (ГПТ).
Аспартатаминотрансфераза (АСТ), по
обратному действию оксалоацетатаминотрансфераза.
АЛТ – катализирует реакцию переноса
между аланином и альфа-кетоглутаратом.
Фермент локализован в цитозоле и большее
его количество зарегистрировано в
печени (в печени больше) и сердце (!).
АСТ – катализ переноса между аспартатом
и альфа-кетоглутаратом. Фермент
сосредоточен в митохондриях сердца (в
сердце больше) и печени.
Биологическое значение трансаминирования.
Так как реакции обратимы возможно
перераспределение азотистого баланса
(при необходимости скинуть лишний азот
через глутамат в орнитиновом цикле),
синтезе заменимых аминокислот из
соответсвующих кетокислот на нужды
клетки, окисление в ЦТК с выделением
энергии или участие в глюконеогенезе
для повышения глюкозы в крови.
Диагностическое значение АСТ и АЛТ.
Так как эти аминотрансферазы имеют
разную количественную локализацию, то
при повышении активности в крови одного
из них свидетельствует о патологическом
процессе в органе и глубине повреждения
его клеток (например, при локализации
в митохондриях кардиомиоцитах фермента
АСТ, можно судить о глубоких повреждениях
клеток при повышении активности фермента
в крови). Данный диагностический
показатель называется коэфициент де
Риттиса и равен 1.33 плюс/минус 0.42.
Отхождение от нормы в несколько раз
может помочь в диагностике гепатита и
инфаркте миокарда (На кафедре нормальной
физиологии при изучении сердцечного
цикла вам говорили что «ЭКГ – наше
все!», а я вам скажу что данный лабораторный
показатель – наиболее точнее. (С) С.Л.
Галян.
Дезаминирование аминоксилот.
Реакция отщепления альфа-аминогруппы
от аминокислоты с образование кетокислоты
и выделение молекулы аммиака. Аммиак
токсичен для ЦНС, поэтому необходимо
его превращение в безвредное вещество
– мочевину. Безазотистый остаток
используется для образования аминокислот
в реакцияъ трансаминирования,
глюконеогенеза, кетогенеза.
Окислительное дезаминирование.
Наиболее активно данному процессу
подвергается глутамат. Реакцию
катализирует НАД-зависимая дегидрогеназа.
В начале происходит ферментативное
дегидрирование с образованием
альфа-иминоглутарата. Затем, неферментативное
гидролитическое отщепление иминогруппы
с образованием аммиака и альфа-кетоглутарата.
Фермент глутаматдегидрогеназа
активируется кортизолом, для вовлечения
в глюконеогенез. А также активация
происходит при АДФ (для восстановления
энерготрат), а ингибирование происходит
за счет накопления АТФ, ГТФ (здесь уже
для отсутствия необходимости для
образования энергии).
Оксидаза аминокислот.
Фермент действует только в щелочной
среде, поэтому значение его менее важно.
Коферментом выступает ФМН, а механизм
один и тот же.
Непрямое дезаминирование.
Осуществляется в несколько этапов один
из них – это трансаминирование на
глутамат от одной аминокислоты и затем
окислительное дезаминирование глутамата.
Процесс происходит под действием двух
ферментов – пиридоксальзависимой
трансаминазы и НАД-зависимой дегидрогеназы.
Процесс очень важен, так как входе него
происходит дезаминирование многих
аминокислот с образованием кетокислот.
Процесс обратим, поэтому возможно и
образование аминокислот и альфа-кетоглутарата.
Неокислительное дезаминирование.
Этим путем дезаминируются серин, треонин,
гистидин.
Дезаминирование серина.
Катализирует сериндегидратаза. Начинается
с отщепления воды и образования
иминогруппы, заем неферментативным
гидролизом отщепляется молекула аммиака
и образуется пируват.
Дезаминирование треонина приводит к
образованию гидроксибутирата, гистидина
– уроканиновой кислоты.
Соседние файлы в папке Беха Экзамен
- #
- #
Источник
