Диагностический алгоритм очаговых эпителиальных поражений желудка

Диагностический алгоритм очаговых эпителиальных поражений желудка
Бунцева О. А.
аспирант кафедры общей и специализированной хирургии ФФМ МГУ имени М. В. Ломоносова
Эрендженова К. Ю.
ассистент кафедры медицинской кибернетики и информатики МБФ РНИМУ имени Н. И. Пирогова
Раузина С. Е.
к. м. н., доцент кафедры медицинской кибернетики и информатики МБФ РНИМУ имени Н. И. Пирогова
Плахов Р. В.
к. м. н., доцент кафедры госпитальной хирургии № 2 РНИМУ имени Н. И. Пирогова
Федоров Е. Д.
д. м. н., профессор, главный научный сотрудник НИЛ хирургической гастроэнтерологии и эндоскопии РНИМУ имени Н. И. Пирогова
г. Москва
Современные видеоинформационные эндоскопические системы высокой четкости, которые постепенно вытесняют аппаратуру предыдущих поколений, позволяют прицельно рассмотреть микроархитектонику слизистой оболочки желудка — её ямочный рисунок и микрососудистую сеть. Анализ структурных изменений слизистой оболочки предоставляет эндоскописту дополнительные характеристики для проведения дифференциальной диагностики доброкачественных изменений и эпителиальных неоплазий желудка. Большое разнообразие этих признаков, сложности, возникающие при поиске и интерпретации специфических признаков поверхностных неоплазий желудка, особенно в поседневной клинической практике, обуславливают недостаточную полнообъёмность и точность эндоскопического исследования. Это указывает на актуальность автоматизации обработки эндоскопических изображений для дополнительной помощи специалисту. В данной работе была предпринята попытка построить решающее правило оценки типа очагового патологического поражения слизистой оболочки желудка с использованием вычислительных методов анализа. Данное правило может послужить основой для создания автоматизированной системы поддержки принятия решений (СППР), помогающей клиницисту в диагностике и выборе лечебной тактики.
Цель:
Определить возможности узкоспектральной эндоскопии высокого разрешения в дифференциальной диагностике эпителиальных неоплазий и доброкачественных изменений слизистой оболочки желудка, в том числе с помощью разработки информационно-аналитической модели поддержки принятия решения врача.
Материалы и методы:
В клинике с 10.2013 по 01.2015 гг. было проведено проспективное исследование, в которое последовательно вошли результаты обследования и лечения 92 пациентов со 100 поверхностными эпителиальными новообразованиями (ПЭН) или очаговыми поражениями слизистой оболочки желудка, подозрительными на ПЭН. Группа пациентов включала 63 (68,5 %) женщины и 29 (31,5 %) мужчин в возрасте от 24 до 87 лет (средний возраст 62,3 ± 13,6 лет). Размер поражений варьировался от 5 до 70 мм; пять (5 %) ПЭН располагались в кардиальной части желудка, сорок (40 %) — в теле; семь (7 %) — в области угла желудка и 48 (48 %) — в антральном отделе. Эндоскопические исследования проводилось с применением систем высокой четкости EVIS EXERA II и III (Olympus, Япония) и эндоскопов серии GIF H‑180, узкоспектрального режима (NBI), в части случаев дополнительно применялось исследование с увеличением до 115 раз (GIF Q‑160Z)и хромоскопия 0,2 % раствором индигокармина. В обязательном порядке проводилась морфологическая верификация гистологической структуры образований (прицельная биопсия, по показаниям — эндоскопическое удаление очагового образования желудка), на основании чего все случаи были разделены на 4 группы в соответствии с пересмотренной Венской классификацией желудочно-кишечных эпителиальных неоплазий: I группа — без неопластических изменений (воспаление, атрофия, кишечная метаплазия, язвы, эрозии, гиперпластические полипы), II группа — неоплазии легкой степени, III группа — неоплазии тяжелой степени и ранний рак, IV группа — инвазивный рак. Количество случаев в каждой группе составило 71, 12, 11 и 6 соответственно.
Для описания очаговых образований желудка был сформирован набор признаков с перечислением возможных характеристик каждого из них. Общие параметры: возраст, пол пациента, время от первичного выявления ПЭН, признаки рецидива, кровотечения из образования и хронической кровопотери, количество образований в желудке, предшествующая биопсия. При стандартном исследовании в белом свете определялись локализация, размер, макроскопический тип (по Парижской классификации 2002 г.), цвет, характер поверхности образования и наличие фибрина, изъязвления, консистенция, подвижность образования, изменения окружающей слизистой оболочки желудка. При прицельном осмотре в узкоспектральном режиме оценивались параметры ямочного и микрососудистого рисунка, включая общее описание: регулярный или нерегулярный, а также наличие демаркационной линии на границе с окружающей слизистой оболочкой (по аналогии с VS-классификацией профессора K. Yao 2009 г. для эндоскопии с увеличением) и частные относительные характеристики размера, формы, расположения структурных элементов.
Результаты:
С помощью точного критерия Фишера и критерия Крамера из 30 параметров, описывающих эпителиальные образования в желудке, были определены 13 наиболее информативных, статистически значимо разделяющих выделенные группы образований. Это размер очагового поражения (p=1х10–5), тип образования по Парижской классификации (p=3х10–3), фоновое изменение окружающей слизистой оболочки (p=3х10–2), характеристики ямочного рисунка (нерегулярность (p=4х10–7), четкость (p=1х10–5), размер (p=5х10–4) и контуры ямок (p=2х10–7), их взаимное расположение (p=1х10–3), характеристики сосудистого рисунка (нерегулярность (p=3х10–13), размер ямок (p=4х10–5), признаки неоангиогенеза (p=6х10–4)), относительное соотношение толщины желез (ямки эпителия) и капилляров в структуре образования (p=5х10–6), а также наличие четкой границы с окружающей слизистой (демаркационной линии) (p=3х10–4). Таким образом, наиболее значимыми для эндоскопической дифференциальной диагностики эпителиальных неоплазий желудка оказались параметры: 1) нерегулярность сосудистого рисунка, 2) нерегулярность ямочного рисунка, 3) неровность контуров желез, 4) относительное увеличение соотношения толщины желез (ямки эпителия) и капилляров в структуре образования.
Для прогнозирования гистологического типа поверхностных очаговых поражений в желудке было разработано решающее правило с использованием неоднородной последовательной диагностической процедуры Байеса. На определенных 13 наиболее информативных параметрах были получены вероятности распределения образований в каждую из 4‑х выделенных групп. Классифицируемая группа по данному правилу определялась наибольшей вероятностью. С использованием скользящего экзамена была получена следующая точность распределения ПЭН в каждую из групп: I группа — 95,8 % (95 % ДИ 89,2–100), II группа — 16,7 % (95 % ДИ 1,7–48,3), III группа — 90,9 % (95 % ДИ 58,3–100), IV группа — 100 % (95 % ДИ 60–100). Небольшой размер выборок 2, 3 и 4 групп определяет широкий доверительный интервал и соответственно низкую точность полученных данных (несмотря на высокие показатели частот распределения), что требует продолжения исследования и увеличения этих групп пациентов.
Однако при более общем разделении очаговых изменений в желудке на две крупные группы с использованием скользящего экзамена точность распределения оказалась достаточно высока и составила для неопухолевых образований — 95,8 % (95 % ДИ 89,2–100) и для неоплазий — 79,3 % (95 % ДИ 61,3–92,5). Это указывает на высокую точность выявленных эндоскопических параметров и разработанного решающего правила в принципиальной дифференцировке очаговых изменений в слизистой оболочке желудка на доброкачественные и неопластические (рис 1–4).
Рис. 3. Высокодифференцированная аденокарцинома. Выраженно измененный и разрушенный ямочный рисунок в центре образования Рис. 4. Высокодифференцированная аденокарцинома (NBI). Нерегулярная мелкая сеть из извитых сосудов
Многочисленность информативных параметров, установленных в настоящем исследовании, и сложность их корреляций с гистологическим типом ПЭН затрудняет их практическое применение врачом непосредственно в процессе исследования, а уменьшение параметров снижает точность распределения в группы. Для успешной и быстрой оценки этих параметров, а, возможно, и выявления новых признаков могут использоваться современные методы компьютерной обработки эндоскопических изображений и компьютерный анализ, использование которых планируется в дальнейшем 1 .
Выводы:
На основе результатов исследования создано эффективное решающее правило для принципиальной дифференциальной диагностики неоплазий и доброкачественных очаговых поражений слизистой оболочки желудка при эндоскопическом исследовании. Однако необходимы дальнейшие исследования для выявления высокоинформативных эндоскопических признаков различных групп неоплазий и разработки эффективной системы поддержки принятия решений врача-эндоскописта, в том числе и с применением компьютерного анализа.
1 Работа проводилась в рамках проекта, выполняемого ООО «СИАМС», при поддержке Министерства образования и науки РФ (Соглашение о предоставлении субсидии от 27.06.2014 № 14.576.21.0018).
Источник
Диагностический алгоритм очаговых эпителиальных поражений желудка
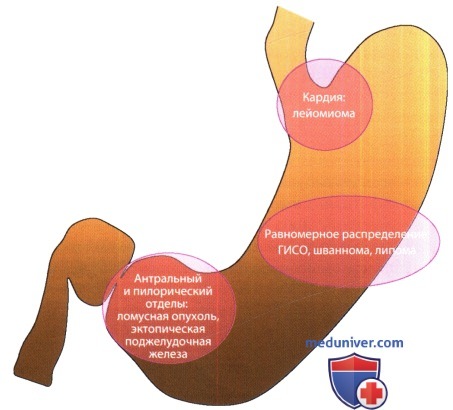
Согласно классификации ВОЗ (2000), опухоли желудка подразделяют на эпителиальные и неэпителиальные, а также выделяют вторичные поражения (Fenoglio-Preiser et al., 2000). Как и во многих других органах, в желудке могут возникать не только эпителиальные опухоли и лимфомы, но также и широкий спектр мезенхимальных опухолей. Приблизительно 3% опухолей желудка относят к последней группе. Мезенхимальные опухоли желудка по их клеточному происхождению могут быть подразделены на пять основных групп:
— истинные опухоли гладкомышечных клеток (лейомиома, гломусная опухоль, лейомиосаркома);
— нейрогенные опухоли (шваннома, нейрофиброма, ганглионеврома, параганглиома);
— фибробластические опухоли (десмоид, воспалительная миофибробластическая опухоль);
— липоматозные опухоли (липома);
— гастроинтестинальная стромальная опухоль (ГИСО), которая имеет уникальный иммуногистохимический (ИГХ) профиль (Fenoglio-Preiser et al., 2000).
При визуализационных и патоморфологических исследованиях выявляют субэпителиальную локализацию этих опухолей. Отличить между собой лейомиому, шванному и ГИСО только лишь с помощью окрашивания гематоксилином и эозином может быть затруднительным, поэтому необходимо проведение ИГХ-исследования. Помимо опухолей, некоторые виды доброкачественных заболеваний, например эктопическая поджелудочная железа, кистозный гастрит и ами-лоидома, также имеют субэпителиальное расположение.
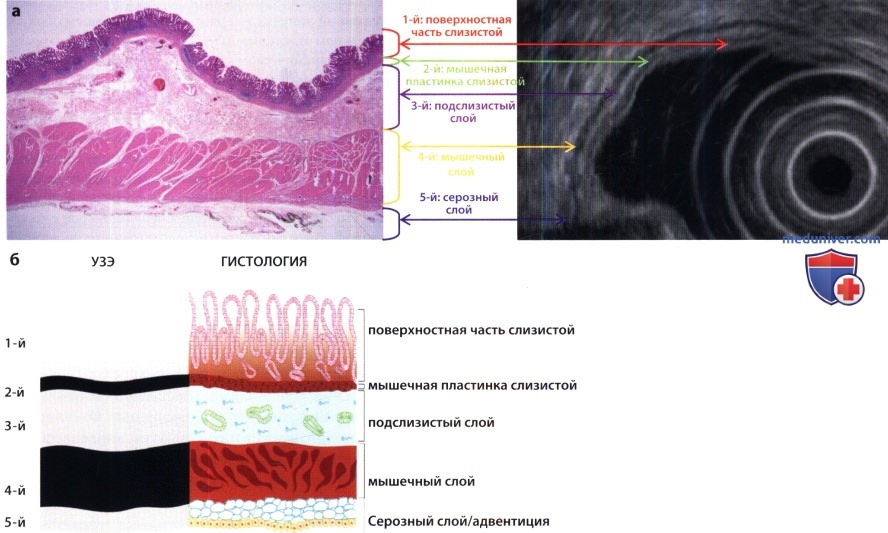
С помощью ультразвуковой эндоскопии (УЗЭ) можно получить информацию об опухоли, касающуюся ее конкретной внутристеночной локализации, размеров, границ, гомогенности, взаимоотношения с прилежащими органами и наличия лимфаденопатии. При УЗЭ стенка желудка состоит из пяти слоев различной эхогенности:
— 1 — самый внутренний гиперэхогенный слой, представляющий собой границу просвета и слизистой оболочки и поверхностную часть слизистой оболочки
— 2 — гипоэхогенный слой мышечной пластинки слизистой оболочки
— 3 — гиперэхогенный подслизистый слой
— 4 — гипоэхогенный мышечный слой
— 5 — самый наружный серозный слой.
Несмотря на то что в некоторых местах слои перекрываются, четкое представление о том, в каком слое локализуется и из какого слоя произрастает опухоль, может быть информативным для сужения круга диагностического поиска среди субэпителиальных образований. Например, можно с уверенностью говорить о наличии миогенной субэпителиальной опухоли, например лейомиомы или ГИСО, если выявлена связь между гипоэхогенной опухолью и 2-м или 4-м мышечным слоем прилежащей стенки желудка.
КТ предоставляет различную информацию о субэпителиальных опухолях желудка, касающуюся локализации, размера, границ, гомогенности, типа роста, лимфаденопатии, кальцификации, инвазии в прилежащие органы и наличия метастазов. Именно поэтому КТ служит информативным методом для проведения дифференциального поиска между субэпителиальными опухолями желудка.
Схема, отражающая места преимущественной локализации субэпителиальных поражений желудка. Лейомиома желудка обычно располагается в кардиальном отделе. Антральный и пилорический отделы — частая локализация гломусной опухоли и эктопической поджелудочной железы. Связь изменений, выявляемых при ультразвуковой эндоскопии (УЗЭ) и гистологии, со схемой строения нормальной стенки желудка.
(а) Изображение реального гистологического строения и УЗЭ.
(б) Соответствующая схема. При УЗЭ стенка желудка состоит из пяти слоев различной эхогенности:
(1) самый внутренний гиперэхогенный слой, представляющий собой границу просвета и слизистой оболочки и поверхностную часть слизистой оболочки;
(2) гипоэхогенный слой мышечной пластинки слизистой оболочки; (3) гиперэхогенный подслизистый слой; (4) гипоэхогенный мышечный слой; (5) самый наружный серозный слой.
Редактор: Искандер Милевски. Дата публикации: 19.5.2019
Источник
Источник
Классификация субэпителиальных поражений желудкаСогласно классификации ВОЗ (2000), опухоли желудка подразделяют на эпителиальные и неэпителиальные, а также выделяют вторичные поражения (Fenoglio-Preiser et al., 2000). Как и во многих других органах, в желудке могут возникать не только эпителиальные опухоли и лимфомы, но также и широкий спектр мезенхимальных опухолей. Приблизительно 3% опухолей желудка относят к последней группе. Мезенхимальные опухоли желудка по их клеточному происхождению могут быть подразделены на пять основных групп: При визуализационных и патоморфологических исследованиях выявляют субэпителиальную локализацию этих опухолей. Отличить между собой лейомиому, шванному и ГИСО только лишь с помощью окрашивания гематоксилином и эозином может быть затруднительным, поэтому необходимо проведение ИГХ-исследования. Помимо опухолей, некоторые виды доброкачественных заболеваний, например эктопическая поджелудочная железа, кистозный гастрит и ами-лоидома, также имеют субэпителиальное расположение.
С помощью ультразвуковой эндоскопии (УЗЭ) можно получить информацию об опухоли, касающуюся ее конкретной внутристеночной локализации, размеров, границ, гомогенности, взаимоотношения с прилежащими органами и наличия лимфаденопатии. При УЗЭ стенка желудка состоит из пяти слоев различной эхогенности: Несмотря на то что в некоторых местах слои перекрываются, четкое представление о том, в каком слое локализуется и из какого слоя произрастает опухоль, может быть информативным для сужения круга диагностического поиска среди субэпителиальных образований. Например, можно с уверенностью говорить о наличии миогенной субэпителиальной опухоли, например лейомиомы или ГИСО, если выявлена связь между гипоэхогенной опухолью и 2-м или 4-м мышечным слоем прилежащей стенки желудка. КТ предоставляет различную информацию о субэпителиальных опухолях желудка, касающуюся локализации, размера, границ, гомогенности, типа роста, лимфаденопатии, кальцификации, инвазии в прилежащие органы и наличия метастазов. Именно поэтому КТ служит информативным методом для проведения дифференциального поиска между субэпителиальными опухолями желудка.
– Также рекомендуем “Рентгенограмма, КТ, УЗИ при гастроинтестинальной стромальной опухоли желудка” Редактор: Искандер Милевски. Дата публикации: 19.5.2019 |
Источник
[12-032]
Гистологическое исследование эндоскопического материала (бронх, гортань, трахея, пищевод, желудок, кишка, за исключением многофокусных биопсий ЖКТ при воспалительных заболеваниях)
2280 руб.
Изучение под микроскопом клеток образцов измененных тканей, взятых при проведении эндоскопии.
Синонимы русские
Эндоскопическая биопсия, морфологическое исследование, гистология, эндотрахеальная биопсия, колоноскопия с биопсией, фиброгастродуоденоскопия (ФГДС) с биопсией, желудочная биопсия, кишечная биопсия, биопсия мочевого пузыря, биопсия бронхов, биопсия гортани.
Синонимы английские
Endoscopic biopsy, histology, morphological study, endobronchial biopsy (EBB), colonoscopy with biopsy, esophagogastroduodenoscopy (EGD) with biopsy, intestinal biopsy, gastric biopsy, duodenal biopsy, endobronchial biopsy, bladder biopsy.
Метод исследования
Гистологический метод.
Какой биоматериал можно использовать для исследования?
Любую ткань, полученную во время проведения эндоскопии.
Как правильно подготовиться к исследованию?
- Специальная подготовка нужна только для проведения эндоскопии. Для гистологического исследования полученного материала она не нужна.
Общая информация об исследовании
Гистологическое исследование эндоскопического диагностического материала заключается в изучении под микроскопом фрагментов тканей, взятых во время проведения эндоскопии.
Эндоскоп (оптический прибор) вводится в полости организма через естественные пути (например, через гортань в бронхи и лёгкие), а также путём проколов или операционных доступов (лапароскопия и др.). Диагностическая эндоскопия широко используется в гастроэнтерологии, позволяя исследовать желудочно-кишечный тракт: пищевод (эзофагоскопия), желудок (гастроскопия), двенадцатиперстную (дуоденоскопия) и толстую кишку (ректороманоскопия, колоноскопия). Также широко применяется и в других областях медицины: пульмонологии (бронхоскопия), оториноларингологии (ларингоскопия), урологии (цистоскопия), гинекологии (кольпоскопия, гистероскопия). При проведении эндоскопии для общих диагностических целей или при обнаружении отклонений берутся образцы тканей с помощью щетки, иглы или щипцов для последующего гистологического анализа. Если необходимо, могут проводиться неотложные меры, такие как купирование сосудистого кровотечения, удаление полипов. Морфологический анализ тканей позволяет диагностировать и верифицировать не только измененные клетки и воспаление в образцах тканей, но и может обнаружить возбудителя инфекции (например, Helicobacter pylori).
Гистологическое исследование играет незаменимую роль при верификации онкологических заболеваний. Это связано с тем, что диагноз в онкологии всегда морфологический. Независимо от того, насколько лечащий врач уверен в том, что он имеет дело с той или иной опухолью, диагноз не считается точным, пока патоморфолог не исследует ткань этой опухоли и не даст свое заключение.
Для чего используется исследование?
- Для определение вида и подвида опухоли, степени ее злокачественности и распространенности онкологического процесса;
- для диагностики предраковых заболеваний;
- для подтверждения неонкологических заболеваний, если другими лабораторными методами это не сделать (например, синдрома раздраженного кишечника, саркоидоза);
- для диагностики инфекционных болезней (например, туберкулеза);
- для оценки степени структурных изменений при хронических патологиях (например, ХОБЛ, болезни Крона);
- для подбора адекватной терапии;
- для определения характера оперативных вмешательств;
- для контроля эффективности лечения;
- для первичного отбора пациентов для диспансерного учета и дальнейшего обследования;
- для динамического контроля и прогноза у лиц, находящихся под наблюдением.
Когда назначается исследование?
- При подозрении на онкологическое заболевание;
- при определении степени злокачественности и оценки прогноза заболевания;
- при верификации неонкологических болезней (например, пищевода Барретта, язвенного колита);
- при неэффективности подобранного лечения;
- при полипах, дивертикулах, эрозиях, язвах;
- при кровотечениях;
- при наличии симптомов и отсутствии видимых поражений слизистой оболочки;
- при оценке эффективности терапии;
- при наблюдении за лицами, стоящими на диспансерном учете.
Что означают результаты?
На основании увиденного при микроскопии врач-патоморфолог дает заключение. В нем содержится информация о наличии или отсутствии измененных клеток и/или воспалительного процесса, а также клеточном составе исследуемых образцов. В заключении может присутствовать предварительный или заключительный диагноз, а также микроскопическое описание тканей и найденных клеток. Это поможет лечащему врачу подтвердить или опровергнуть предварительный диагноз, назначить подходящее лечение и, если потребуется, дополнительное обследование.
Расшифровка результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Что может влиять на результат?
Опыт врача по проведению эндоскопии с биопсией.
Важные замечания
- Не стоит проводить биопсию на фоне обострения хронических заболеваний. В таком случае лучше ее сделать после соответствующего лечения пациента. Это не касается только тех случаев, когда биопсия показана при неэффективном лечении.
Также рекомендуется
[12-012] Цитологическое исследование материала, полученного при эндоскопии (ФГДС, бронхоскопия, ларингоскопия, цистоскопия, ректороманоскопия, колоноскопия)
[12-027] Иммуногистохимическое исследование клинического материала (с использованием 1 антитела)
[12-026] Консультация биопсийного (операционного) материала любой сложности (по готовому материалу)
[12-057] Фотофиксация (иллюстрация заключения изображением гистологического препарата)
Кто назначает исследование?
Онколог, гастроэнтеролог, проктолог, пульмонолог, уролог, лор, хирург, эндоскопист, терапевт.
Литература
- Руководство по клинической эндоскопии / В.С.Савельев, Г.И. Лукомского, В.М. Буянов – М.: Книга по Требованию, 2013. – 542 с. ISBN 978-5-458-39550-2, pdf.
- Патологическая анатомия: учебник / А. И. Струков, В. В. Серов. – 5-е изд., стер. – М.: Литтерра,. 2010. – 880 с.
- Dionísio J.: Diagnostic flexible bronchoscopy and accessory techniques.Rev Port Pneumol. 2012 Mar;18(2):99-106. Epub 2012 Feb 7.
- Pulmonary and Critical Care Medicine Service, Department of Medicine, Walter Reed Army Medical Center, Washington, DC 20307, USA. AFSHORR@DNAMAIL.COM. Endobronchial biopsy for sarcoidosis: a prospective study, PMID:11451824.
- Peter Jeffery, Stephen Holgate, Sally Wenzel. Methods for the Assessment of Endobronchial Biopsies in Clinical. PubMed: 14555461.
- Sultan, S., Falck-Ytter, Y., and Inadomi, J.M. The AGA Institute process for developing clinical practice guidelines part one: grading the evidence. Clin Gastroenterol Hepatol. 2013; 11: 329–332.
- Bancroft ID, Stevens A. Theory and practice of histological techniques. New York: Churchill Livingstone; 1996.
Источник