Дендритные клетки при раке желудка

Новости онкологии
19.01.2016
Владимирова Любовь Юрьевна
Руководитель отдела лекарственного лечения опухолей
ФГБУ «НМИЦ онкологии» Минздрава России,
доктор медицинских наук, профессор,
Ростов-на-Дону
Несмотря на определенный прогресс в лечении рака желудка, прогноз больных остается неблагоприятным. За последние несколько лет был получен определенный успех при иммунотерапии меланомы, в лечении которой ее применили впервые, а также при раке молочной железы, раке почки, раке предстательной железы и при немелкоклеточном раке легкого. Поэтому журнал Science в 2013 году назвал иммунотерапию «прорывом года» [1]. Интерес к иммунотерапевтическим подходам в лечении рака желудка все больше возрастает.
Роль иммунной системы
Известно, что иммунная система позволяет отличать «свое» от «чужого». В гипотезе иммуновыживаемости раковых клеток была представлена концепция, согласно которой иммунная система способна находить и уничтожать появившиеся злокачественные клетки [2-4]. Первоначально эта теория была отвергнута, но постепенно в эксперименте были получены весомые доказательства, и теперь они являются частью теории «иммуноредактирования» рака [5].
Этот процесс имеет 3 основные фазы: устранения («elimination»), равновесия («equilibrium») и избегания («escape»). Во время фазы элиминации рост и размер клеток опухоли могут вызывать изменения в микроокружении и локальное повреждение. Клетки иммунной системы, такие как натуральные киллеры и Т-клетки натуральные киллеры, секретируют гамма-интерферон и цитокины, а также осуществляют ингибирование ангиогенеза и пролиферацию клеток опухоли. Затем антигенпрезентирующие дендритные клетки поглощают опухолевые антигены и активируют Т-лимфоциты для развития иммунного ответа. Самой продолжительной из всех трех фаз является фаза равновесия. В этом процессе CD8+Т-клетки, дендридные клетки и опухолевые клетки находятся в фазе динамического баланса и опухолевые клетки находятся в покое. К сожалению, во время этого долгого процесса генетически нестабильные опухолевые клетки могут выживать, приобрести резистентность, и это приводит к фазе избегания.
Другим важным этапом было выделение первого антигена опухолей человека, распознаваемого Т-клетками [6]. Это стало возможно в результате клонирования гена MAGE (melanoma antigen-encoding gene), который кодирует антигены, распознанные цитотоксическими Т-клетками. Это открытие было не только новым доказательством способности нашей иммунной системы находить и разрушать опухолевые клетки, но также впервые была определена молекулярная природа этих антигенов.
Иммунотерапия: вакцины против рака
Вакцина против рака создана с целью усиления способности иммунной системы человека распознавать и разрушать опухолевые клетки путем стимулирования опухолеспецифичных Т-лимфоцитов. В частности, опухолевые антигены должны быть распознаны Т-клетками с помощью специальных антиген-презентирующих клеток (например, дендритных клеток). Обычно эти антигены представляют собой малые внутриклеточные пептиды, которые на поверхности опухолевых клеток имеют молекулы главного комплекса гистосовместимости и распознаются Т-клетками. Молекулы комплекса гистосовместимости I класса отвечают за презентацию антигена СD3+ CD8+, а II класса – СD3+СD4+.
В настоящее время были обнаружены и изучены тысячи опухолевых антигенов. Ген MAGE, впервые найденный у больных меланомой, представлен по-разному в различных солидных опухолях, но он также присутствует на нормальных клетках, не проявляя себя. Другие найденные потенциальные антигены являются пептидами, связанными с мутациями (например, KRAS и связанные с ним мутации), антигены дифференцировки, антигены избыточной экспрессии (например, HER2/neu и раково-эмбриональный антиген) и вирусные антигены (например, HPV).
Рак желудка экспрессирует MAGE в 38% случаев. В доклинических исследованиях показано, каким образом Helicobacter pilori может индуцировать экспрессию МАGE-3 [7,8]. Нановакцина, нагруженная пептидом МАGE-3 с целью усилить иммунный ответ, была изучена на мышиной модели рака желудка. В результате была получена регрессия опухоли [9]. Японскими учеными проведена I/II фаза исследования на 22 больных с распространенным раком желудка с использованием пептидов от VEGF-R1 и VEGF-R2 совместно с применением S-1 и цисплатина. В результате была получена частичная регрессия у 55% больных и увеличение продолжительности общей выживаемости [10]. Кроме того, опухолевые антигены, связанные с HER2/neu, обычно избыточно экспрессируемые при раке желудка, могут играть важную роль в развитии новых подходов к иммунотерапии и вакцинации.
Адоптивная иммунотерапия (или иммунотерапия «адоптивными клетками») является еще одним видом иммунотерапии. Опухолево-специфичные Т-клетки забирают у больного и культивируют in vitro. Затем эти клетки реинфузируются больному в больших количествах. В настоящее время генетическая модификация этих клеток in vitro до их возвращения имеет особое значение. Можно использовать различные типы клеток в качестве активированных киллеров. Некоторые из них были изучены при раке желудка, в том числе лимфоциты, инфильтрирующие опухоль [11].
В одном из последних исследовании у 44 больных с распространенным раком желудка были использованы тумор-ассоциированные лимфоциты в комбинации с или без химиотерапии [12]. Результаты показали, что общая выживаемость была лучше в группе комбинации химиотерапии с тумор-ассоциированными лимфоцитами. Более того, при раке желудка были исследованы цитокин-индуцированные киллеры [13,14]. Клинические исследования подтвердили что больные, которых лечили химиотерапией в комбинации с цитокин-индуцированными киллерами, обработанными in vitro интерлейкином-2 совместно с антителами анти-СD-3, имели лучшую выживаемость по сравнению с больными, которым была проведена только химиотерапия. Однако высокая специфичность обработанных киллеров этого типа является крайне важной, позволяя уменьшить риск жизнеугрожающих побочных эффектов, связанных с выраженным иммунным ответом.
Ингибиторы иммунных контрольных точек
Чтобы избежать избыточной пролиферации и повреждения ткани, необходимо тщательно регулировать активность Т-клеток. В этот процесс включено несколько иммунных контрольных точек. Т-клетки экспрессируют ингибирующие рецепторы CTLA-4 и РD-1. Эти молекулы обычно появляются на поверхности Т-клеток после их активации и передают негативный сигнал. Блокада этих рецепторов с помощью антител вызывает повышенную активность Т-клеток, которая достаточно высока при многих видах опухоли.
Не так давно в геномном атласе рака были проанализированы молекулярные характеристики аденокарциномы желудка [15]. Были выделены 4 опухолевых подтипа: опухоли, позитивные по вирусу Эпштейна-Барр, микросателлитные нестабильные опухоли, геномно-стабильные опухоли и опухоли с хромосомной нестабильностью. В подгруппе с вирусом Эпштейн-Барр, составляющей 15% от всех, выявлена повышенная экспрессия РD-L1, что говорит о выраженном присутствии иммунных клеток при раке желудка и позволяет использовать ингибиторы иммунных контрольных точек.
Было проведено исследование II фазы с использованием тремелимумаба – полностью гуманизированного моноклонального антигена анти CTLA-4 – в качестве 2-й линии терапии 18 больных раком желудка [16]. Хотя объективный ответ отмечен у 5% больных, медиана выживаемости составила 4,8 мес. и соответствовала таковой при лечении рака желудка с использованием химиотерапии.
Кроме того, можно предположить, что комбинация ингибиторов из 2 блокаторов иммунного ответа может быть более эффективна у больных с распространенным раком желудка. Новый препарат MEDI 4736 является моноклональным антигеном человека IgG1, который связывается с РD-L1 и предотвращает его связывание с РD-1 и СD-80. Полученные в I фазе предварительные данные показали многообещающий клинический эффект препарата при многих видах опухоли [17]. Сегодня продолжается несколько исследований MEDI 4736 как монотерапии, так и в комбинации с иммуномодуляторами, например, тремелимумабом.
Ниволумаб – антитело, которое блокирует взаимодействие между РD-1 и соответствующим лигандом РD-L1. Ниволумаб показал впечатляющую эффективность при многих видах опухолей. В декабре 2014 FDA одобрило ниволумаб для лечения нерезектабельной или метастатической меланомы после прогрессирования на ипилимумабе (и BRAF ингибиторе при наличии BRAF V600 мутации). Позже ниволумаб получил одобрение в качестве 2-й линии лечения при плоскоклеточном немелкоклеточном раке легкого. Основой тому послужило улучшение общей выживаемости в сравнении с доцетакселом (9,2 мес. vs 6,0 мес., HR 0,59, р=0,00025).
В настоящее время при раке желудка проводится I фаза исследований этого анти-PD-1 иммуностимулирующего антитела самостоятельно или в комбинации. Доклинические исследования показали, что двойная блокада РD-1 и СТLА-4 приводила к повышению выброса цитокинов и увеличивала пролиферацию СD8+ и СD4+ Т-клеток по сравнению с блокадой одного из рецепторов [18,19]. Продолжаются исследования Ib/II фазы по изучению активности ниволумаба в монотерапии или в комбинации с ипилимумабом у больных метастатическим раком желудка, раком поджелудочной железы, трижды-негативным раком молочной железы и мелкоклеточным раком легкого [20].
Пембролизумаб является высокоспецифичным гуманизированным моноклональным IgG4 антителом, которое блокирует взаимодействие PD-1 c его лигандами PD-L1 и PD-L2. Это антитело показало обещающие результаты у 135 больных метастатической меланомой в большом исследовании I фазы (KEYNOTE-001) [21,22]. Использование пембролизумаба привело к общему ответу у 26% больных и имело управляемый профиль токсичности. На этом основании FDA одобрило его для лечения меланомы. Недавно было проведено исследование по безопасности и активности пембролизумаба у больных раком желудка в I фазе, было скринировано 165 больных распространенным раком желудка и гастроэзофагального соединения [23]. 65 больных (40%) были PD-L1 позитивными (критерием служило окрашивание PD-L1 в строме или ≥1% опухолевых клеток), 39 из них получали пембролизумаб (10 мг/кг) каждые 2 недели. У 41% больных отмечено уменьшение опухоли. Общий ответ в азиатской популяции больных составил 32%, в неазиатской – 30%. Отмечено, что лечение больные перенесли хорошо, даже несмотря на то, что они предварительно получали серьезное лечение. Далее, были получены предварительные доказательства взаимосвязи между выживаемостью без прогрессии, ответом опухоли на лечение и экспрессией PD-L1.
Иммунотерапия в настоящее время выходит на передовую позицию. Получены неожиданные результаты, особенно при лечении меланомы, при которой этот терапевтический подход позволил улучшить выживаемость. При раке желудка, несмотря на некоторые результаты, требуется дальнейшее изучение этого вопроса. Кроме того, открытие эффективных биомаркеров позволило бы сделать важный шаг в определении групп больных, где иммунотерапия была бы оптимальной. Это могло бы не только увеличить количество больных, у которых возможен эффект от лечения, но также выделить больных, у которых возможно развитие выраженной токсичности. Такой подход поможет определить экономическую выгоду от лечения. Следовательно, дальнейшие клинические исследования могли бы быть посвящены изучению потенциальных биомаркеров, таких как экспрессия PD-L1, инфильтрации иммунными клетками (например, СD8/регуляторные Т-клетки и хемокины) и использования частоты мутаций в опухоли.
Литература:
- Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science 2013; 342: 1432-1433.
- Burnet FM. Cancer: a biological approach. Brit Med J. 1957; 1: 841-847.
- Burnet FM. The concept of immunological surveillance. Prog Exp Tumor Res. 1970; 13: 1-27.
- Thomas L. Cellular and Humoral Aspects of the Hypersensitive es. Sherwood Lawrence, MD New York, Paul B. Hoeber, Inc., 1959, 667 pp.
- Dunn GP, Bruce AT, Ikeda H, et al. Cancer immunoediting: from immuno-surveillance to tumor escape. Nat Immunol. 2002; 3: 991-998.
- Van der Bruggen, Traversari C, Chomez P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science. 1991; 254: 1643-1647.
- Inoue H, Mori M, Honda M, et al. The expression of tumor-rejection antigen ‘MAGE’ genes in human gastric carcinoma. Gastroenterology. 1995; 109: 1522-1525.
- Fukuyama T, Yamazaki T, Fujita T, et al. Helicobacter pylori, a carcinogen, induces the expression of melanoma antigen-encoding gene (Mage)-A3, a cancer/testis antigen. Tumor Biol. 2012; 33: 1881-1887.
- Yang J, Li ZH, Zhou JJ, et al. Preparation and antitumor effects of nanovaccines with MAGE-3 peptides in transplanted gastric cancer in mice. Chin J Cancer. 2010; 29: 359-364.
- Masuzawa T, Fujiwara Y, Okada K, et al. Phase I/II study of S-1 plus cisplatin combined with peptide vaccines for human vascular endothelial growth factor receptor 1 and 2 in patients with advanced gastric cancer. Int J Oncol. 2012; 41: 1297-1304.
- Yamaue H, Tanimura H, Tsunoda T, et al. Clinical application of adoptive immunotherapy by cytotoxic T lymphocytes induced from tumor-infiltrating lymphocytes. Nihon Gan Chiryo Gakkai Shi. 1990; 25: 978-989.
- Kono K, Takahashi A, Ichihara F, et al. Prognostic ificance of adoptive immunotherapy with tumor-associated lymphocytes in patients with advanced gastric cancer: a randomized trial. Clin Cancer Res. 2002; 8: 1767-1771.
- Jiang J, Xu N, Wu C, et al. Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells. Anticancer Res. 2006; 26: 2237-2242.
- Jiang JT, Shen YP, Wu CP, et al. Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients. World J Gastroenterol. 2010; 16: 6155-6162.
- The Cancer Genome Atlas Re Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-209.
- Ralph C, Elkord E, Burt DJ, et al. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2008; 16: 1662-1672.
- Segal N. Preliminary data from a multi-arm expansion study of MEDI4736, an anti-PD-L1 antibody. J Clin Oncol. 32:5s, 2014 (suppl; abstr 3002).
- Curran MA, Montalvo W, Yagita H, et al. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Prc Natl Acad Sci USA. 2010; 107: 4275-4280.
- Duraiswamy J, Kluger H, Callahan MK, et al. Dual blockade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-cell rejection in tumors.Cancer Res. 2013; 369: 122-133.
- Callahan M, Bendell J, Chan E, et al. Phase I/II, open-label study of nivolumab (anti-PD-1; BMS-936558, ONO-4538) as monotherapy or combined with ipilimumab advanced or ic solid tumor. J Clin Oncol. 32:5s, 2014 (suppl; abstr TPS3114).
- Hamid O, Robert C, Daud A, et al. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med. 2013; 369: 134-144.
- Robert C, Ribas A, Wolchok JD,e t al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet. 2014; 384: 1109-1111.
- Muro K, Bang Y, Shankaran V, et al. A phase 1b study of pembrolizumab in patients with advanced gastric cancer. Annals Onc. 2014; Suppl 5: v1-v41.
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник
Основа биовакцины – это материал опухолевого образования. Важно понимать, что использование вакцины на основе дендритных клеток является лишь частью комплексной терапии в лечении рака.
Дендритные клетки т.е. вакцину на их основе изготавливают после хирургического лечения с применением полученного в процессе вмешательства опухолевого материала, а также клеток, выделенных из крови больного.
После этого пациент продолжает основной курс терапии (химиотерапию или другое) и после его окончания несколько раз получает дендритную вакцину, при помощи которой удается закрепить полученный результат терапии. Это обеспечивает профилактику рецидива и развития метастазов.
До настоящего момента в мире было проведено более 1000 клинических испытаний биовакцин где применялись дендритные клетки. В этих испытаниях принимали участие больные с распространенными стадиями рака, и в результате был сделан вывод, что использование биовакцин должно быть направлено не только на борьбу с опухолью, но и на профилактику рецидивов и образования метастазов.
Роль дендритной вакцины в лечении рака сложно переоценить, ведь большинство летальных исходов при онкологических опухолях возникает в результате прогрессирования патологии и развития метастазов.
На сегодняшний день нами получены результаты клинических исследований, а изготовление дендритной вакцины проводится усовершенствованным методом, не имеющим аналогов во всем мире.

Роль дендритных клеток
Дендритные клетки являются важным звеном в формировании приобретенного иммунитета. Согласно данным медицинских исследований, количество дендритных клеток в организме пациента со злокачественными опухолями существенно снижено, а сами они функционируют неполноценно.
Считается, что снижение количества дендритных клеток и потеря эффективности их работы является одной из основных причин отсутствия полноценной иммунологической защиты организма на развивающийся раковый процесс.
Из этого можно сделать вывод, что даже при введении антигенов непосредственно в патологический очаг не наблюдается активизации иммунитета в нужном объеме. При культивировании дендритных клеток в условиях in vitro часто удается избежать отрицательного действия иммунносупрессивных факторов и обеспечить полноценное созревание этих клеток.
Дендритные клетки культивируют в среде, которая содержит материал опухоли. Для изготовления вакцины материал, взятый из опухоли, обрабатывается специальным образом, что позволяет повысить иммуногенность опухолевых антигенов.
Индивидуальное изготовление вакцины для каждого пациента
Биовакцины, изготовленные индивидуально для каждого отдельного пациента, на сегодняшний день являются самыми безопасными и высокоэффективными в лечении онкологических заболеваний. Благодаря проведенным исследованиям было установлено, что использование вакцин на основе дендритных клеток в составе комплексного лечения рака позволило существенно повысить продолжительность и качество жизни пациентов.
После введения вакцины в организм дендритные клетки перемещаются в лимфоидную ткань, где участвуют в обучении Т-лимфоцитов и инициируют их пролиферацию. Терапевтический эффект вакцины заключается в активизации цитотоксических Т-лимфоцитов, активность которых у онкологических больных существенно снижена.
Читать также: Инновационное открытие в лечении онкологии
На консультации обсуждаются: – методы инновационной терапии;
– возможности участия в экспериментальной терапии;
– как получить квоту на бесплатное лечение в онкоцентр;
– организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Источник

Изучение механизмов иммунного ускользания опухоли показало, что рост, метастазирование и прогноз злокачественного новообразования зависят от функционирования иммунной системы пациента [1]. В настоящее время ведутся интенсивные работы по разработке и внедрению методов лечения, которые основаны на активации компонентов клеточного и гуморального противоопухолевого иммунитета. Одним из наиболее изученных и клинически эффективных методов является вакцинация с помощью дендритных клеток.
Дендритные клетки (ДК) – компонент клеточного звена врожденного иммунитета, выполняют антигенпрезентирующую и регуляторную функцию [2].
В организме человека ДК представлены гетерогенной популяцией, не имеющей одного общего антигенного маркера. Выделяют два основных типа ДК, которые в отечественной литературе называются миелоидными ДК (мДК) и плазмоцитоидными ДК (пДК), в зависимости от клетки-предшественницы (Рис. 1) [3].
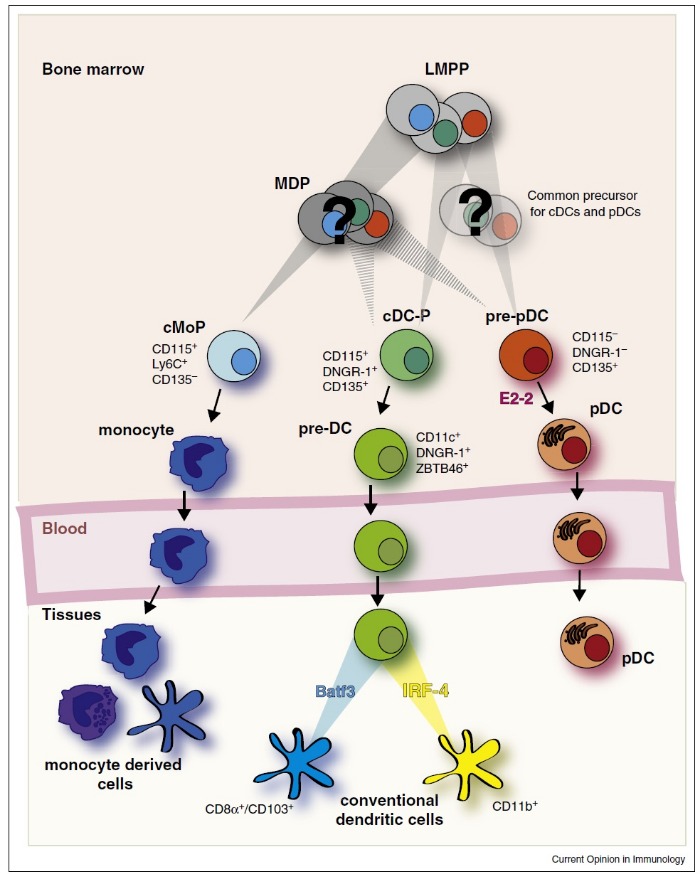 Рисунок 1 | Образование и дифференцировка подтипов ДК (подробности в тексте) [3].
Рисунок 1 | Образование и дифференцировка подтипов ДК (подробности в тексте) [3].
MDP – общий предшественник клеток миелопоэза; LMPP – общий предшественник лимфопоэза; pDC – пДК; conventional dendritic cells – мДК; monocyte derived cells – ДК, дифференцирующиеся из моноцитов.
Большинство ДК образуются из клетки-предшественника миелопоэза и представляют собой мДК, поэтому в зарубежной литературе для них введено понятие «конвенциональные ДК» (conventional DC). Часть ДК образуются из клетки-предшественницы лимфопоэза – это пДК [3]. Кроме того, было показано, что моноциты при определенных условиях могут трансформироваться в дендритные клетки [4], а также неопределенной остается классификационное положение резидуальных тканевых моноцитов (например, клеток Лангханса) [2].
После завершения дифференцировки ДК покидают костный мозг и с током крови достигают периферических органов и лимфатических узлов [3]. По некоторым данным, период полужизни ДК составляет от 5 до 7 дней в селезенке, лимфатических узлах, печени и почках, но может достигать и 25 дней (например, в легких) [5,6].
В отсутствие специфических медиаторов воспаления, фрагментов микробных клеток или других активаторов, дендритные клетки находятся в «спящем» состоянии (толерогенная форма), что выражается в продукции ими иммуносупрессорных молекул и индукции Treg лимфоцитов. В случае попадания в межклеточную среду активаторов ДК превращаются в зрелую форму и модулируют компоненты врожденного и адаптивного иммунитета, а также выполняют антигенпрезентирующую функцию (Рис. 2). При этом ДК мигрируют с периферии в регионарные лимфатические узлы [7].
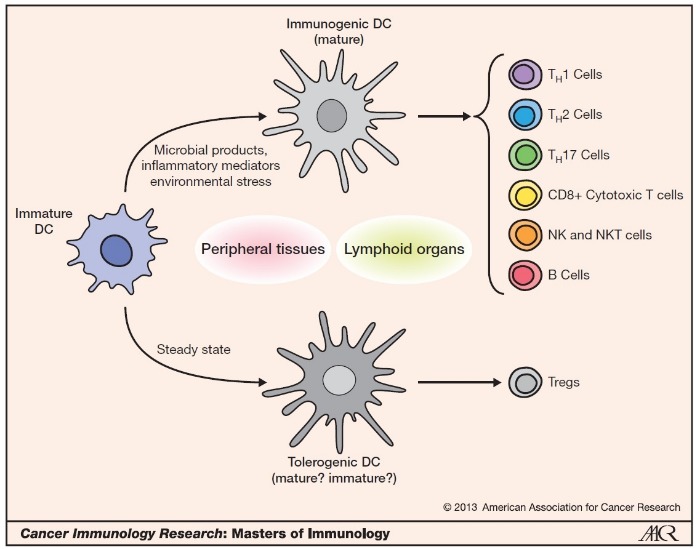 Рисунок 2 | Две основных формы существования дендритных клеток: «спящая»/толерогенная и активная/зрелая форма (пояснения в тексте).
Рисунок 2 | Две основных формы существования дендритных клеток: «спящая»/толерогенная и активная/зрелая форма (пояснения в тексте).
Зрелые ДК могут иметь разнообразный набор антигенов, но важнейшим является наличие молекул главного комплекса гистосовместимости II класса (MHC-II), с помощью которых ДК могут активировать CD8+ и CD4+ лимфоциты, запуская адаптивный иммунный ответ. Для модуляции работы клеток иммунной системы на поверхности ДК имеются различные рецепторы и костимуляторы, представленные на рисунке 3.
Рисунок 3 | Основные рецепторы зрелой ДК.
CD86, CD80 – костимуляторы передачи сигнала Т-лимфоцитам;
CD40 – стимулирует продукцию ИЛ-12 и ИФН-γ Т-хелперами;
А – молекулы межклеточной адгезии;
TLR – toll-like рецепторы, необходимы для захвата антигенов;
К – рецепторы к компонентам комплемента;
Кроме стандартного для антигенпрезентирующих клеток (АПК) представления антигена через MHC-II, ДК способны встраивать захваченный антиген в MHC-I, напрямую активируя CD8+ лимфоциты [7].
Рисунок 4 | Взаимодействие ДК с Т-лимфоцитами. Комплексы антиген+MHC-I и MHC-II распознаются рецепторами Т-лимфоцитов (TCR), при этом ДК выделяет медиаторы, способствующие дифференцировки CD4+ клеток либо в Th1, либо в Th2.
ДК участвуют во всех типах специфических иммунных реакций, в том числе и в противоопухолевом иммунитете [8]. Способность активировать клеточное звено иммунитета и высокая эффективность передачи антигена позволяет выделить ДК среди других АПК в качестве потенциальной мишени для противоопухолевой терапии.
Терапия с использованием ДК получила название «вакцинация дендритными клетками». Суть метода заключается в создании искусственного активного специфического иммунитета в отношении опухоли, однако для большей эффективности вводятся не сами антигены злокачественных клеток, а индуцированные ДК [9]. При этом ДК не просто выполняют роль АПК, а еще и выделяют ряд цитокинов (ИЛ-12, ИЛ-6, ИФН-γ, ФНО-α), которые потенцируют пролиферацию и созревание иммунокомпетентных клеток [8, 9]. Протокол иммунотерапии ДК включает следующие этапы: забор ДК или их предшественников у пациента; индукцию их превращения в незрелые ДК; стимуляцию «созревания ДК»; введение клеток в организм пациента (Рис. 5) [9, 10]
Рисунок 5 |Этапы иммунотерапии с использованием ДК (подробности в тексте) [9].
Небольшое количество ДК можно получить непосредственным выделением из периферической крови пациента, однако их количество и фенотип могут быть неподходящими для эффективной иммунотерапии [11, 12]. Кроме того, ДК могут быть получены из клеток-предшественников, экспрессирующих CD34+, которые изолируют из костного мозга, периферической или пуповинной крови [13, 14]. Однако стандартным и наиболее эффективным методом является получение ДК из моноцитов периферической крови пациента, в связи с простотой метода и большим количеством получаемых клеток [9, 10]. Ряд исследований показал высокую эффективность ДК, полученных из моноцитов при иммунотерапии злокачественных опухолей [15-17].
Для превращения моноцитов в незрелые дендритные клетки их инкубируют со смесью цитокинов, которая содержит гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и один из цитокинов, ИЛ-4, ФНО-α или ИФН-α. ГМ-КСФ поддерживает пролиферацию и жизнеспособность клеток миелоидного ростка, а дополнительные цитокины способствуют дифференцировке в незрелые ДК. Незрелые ДК «нагружают» опухолевыми антигенами – инкубируют в среде, содержащей опухоль-специфичные пептиды, нуклеиновые кислоты, лизаты опухолевых клеток. В настоящее время вопрос оптимального варианта антигенной «нагрузки» ДК остается открытым. Активно изучается и показал хорошие результаты метод с использованием цельных опухолевых клеток и совместного культивирования ДК и опухоли [18, 19].После этого начинается «созревание» ДК. Этот этап необходим для экспрессии ДК рецепторов, необходимых для выполнения антигенпрезентирующей функции, кроме того, зрелые ДК начинают секретировать регуляторные цитокины. Для индукции созревания обычно используются различные комбинации ФНО-α с цитокинами, такими как ИЛ-1β, ИЛ-6, PGE2, ИЛ-18, интерфероны и лиганды TLR [9].
Зрелые ДК вводят в организм пациента внутрикожно, внутривенно, в лимфатические узлы или напрямую в опухолевый очаг [10].
Внедрение вакцин на основе ДК в клиническую практику началось в середине 90-х годов. Это были вакцины на основе ДК моноцитарного происхождения, культивированных со специфичными антигенами меланомы, такими как MART-1/Melan A и gp100 [20-22]. Кроме того, испытывались вакцины против В-клеточной лимфомы, миеломы, острого миелобластного лейкоза, рака предстательной железы и гепатоцеллюлярной карциномы (ГЦК) [20, 23-27]. Результаты исследований показали безопасность и иммуногенность вакцин на основе ДК. В случае ГЦК и меланомы удалось добиться активации CD8+-лимфоцитов не позднее 7 дня от начала терапии. В большинстве исследований принимали участие пациенты на поздних стадиях опухолевого процесса, однако у 10 % удалось добиться стойкой ремиссии заболевания. Кроме моноцитарных ДК, клинические испытания прошли вакцины на основе ДК, полученных из CD34+-клеток, а также плазмоцитоидные ДК. В обоих случаях вакцины обладали клинической эффективностью и были безопасны [28, 29].
В последнее время идет работа в области повышения эффективности доставки ДК в лимфатические узлы с помощью инъекций напрямую в лимфатические сосуды [30], а также в области сочетания вакцин из ДК и других вариантов иммунотерапии, например, блокады иммунологических контрольных «точек» (checkpoint blockade) [31].
Источники:
- Candeias SM, Gaipl US. The Immune System in Cancer Prevention, Development and Therapy. Anticancer Agents Med Chem. 2016;16(1):101-7.
- Liu K, Nussenzweig MC. Origin and development of dendritic cells. Immunol Rev. 2010;234(1):45-54.
- Schraml BU, Reis e sousa C. Defining dendritic cells. Curr Opin Immunol. 2015;32:13-20.
- Randolph GJ, Beaulieu S, Lebecque S, Steinman RM, Muller WA. Differentiation of monocytes into dendritic cells in a model of transendothelial trafficking. Science. 1998;282(5388):480-3.
- Ginhoux F, Liu K, Helft J, et al. The origin and development of nonlymphoid tissue CD103+ DCs. J Exp Med. 2009;206(13):3115-30.
- Liu K, Waskow C, Liu X, Yao K, Hoh J, Nussenzweig M. Origin of dendritic cells in peripheral lymphoid organs of mice. Nat Immunol. 2007;8(6):578-83.
- Mellman I. Dendritic cells: master regulators of the immune response. Cancer Immunol Res. 2013;1(3):145-9.
- Gardner A, Ruffell B. Dendritic Cells and Cancer Immunity. Trends Immunol. 2016;37(12):855-865.
- Santos PM, Butterfield LH. Dendritic Cell-Based Cancer Vaccines. J Immunol. 2018;200(2):443-449.
- Elster JD, Krishnadas DK, Lucas KG. Dendritic cell vaccines: A review of recent developments and their potential pediatric application. Hum Vaccin Immunother. 2016;12(9):2232-9.
- Nair S, Archer GE, Tedder TF. Isolation and generation of human dendritic cells. Curr Protoc Immunol. 2012;Chapter 7:Unit7.32.
- Alculumbre S, Pattarini L. Purification of Human Dendritic Cell Subsets from Peripheral Blood. Methods Mol Biol. 2016;1423:153-67.
- Smeland EB, Funderud S, Kvalheim G, et al. Isolation and characterization of human hematopoietic progenitor cells: an effective method for positive selection of CD34+ cells. Leukemia. 1992;6(8):845-52.
- Ueno H, Tcherepanova I, Reygrobellet O, et al. Dendritic cell subsets generated from CD34+ hematopoietic progenitors can be transfected with mRNA and induce antigen-specific cytotoxic T cell responses. J Immunol Methods. 2004;285(2):171-80.
- Kuhn S, Yang J, Ronchese F. Monocyte-Derived Dendritic Cells Are Essential for CD8(+) T Cell Activation and Antitumor Responses After Local Immunotherapy. Front Immunol. 2015;6:584.
- Vopenkova K, Mollova K, Buresova I, Michalek J. Complex evaluation of human monocyte-derived dendritic cells for cancer immunotherapy. J Cell Mol Med. 2012;16(11):2827-37.
- Butterfield LH. Dendritic cells in cancer immunotherapy clinical trials: are we making progress?. Front Immunol. 2013;4:454.
- Pinho, M. P., B. S. Sundarasetty, P. C. Bergami-Santos, K. Stepoicius-Cruz, A. K. Ferreira, R. Stripecke, and J. A. Barbuto. 2016. Dendritic-tumor cell hybrids induce tumor-specific immune responses more effectively than the simple mixture of dendritic and tumor cells. Cytotherapy 18: 570-580.
- Bonifaz, L. C., D. P. Bonnyay, A. Charalambous, D. I. Darguste, S. Fujii, H. Soares, M. K. Brimnes, B. Moltedo, T. M. Moran, and R. M. Steinman. 2004. In vivo targeting of antigens to maturing dendritic cells via the DEC-205 receptor improves T cell vaccination. J. Exp. Med. 199: 815-824.
- Butterfield, L. H., A. Ribas, V. B. Dissette, S. N. Amarnani, H. T. Vu, D. Oseguera, H. J. Wang, R. M. Elashoff, W. H. McBride, B. Mukherji, et al. 2003. Determinant spreading associated with clinical response in dendritic cellbased immunotherapy for malignant melanoma. Clin. Cancer Res. 9: 998-1008.
- Mukherji, B., N. G. Chakraborty, S. Yamasaki, T. Okino, H. Yamase, J. R. Sporn, S. K. Kurtzman, M. T. Ergin, J. Ozols, J. Meehan, et al. 1995. Induction of antigen-specific cytolytic T cells in situ in human melanoma by immunization with synthetic peptide-pulsed autologous antigen presenting cells. Proc. Natl. Acad. Sci. USA 92: 8078-8082.
- Nestle, F. O., S. Alijagic, M. Gilliet, Y. Sun, S. Grabbe, R. Dummer, G. Burg, and D. Schadendorf. 1998. Vaccination of melanoma patients with peptide- or tumor lysate-pulsed dendritic cells. Nat. Med. 4: 328-332.
- Hsu, F. J., C. Benike, F. Fagnoni, T. M. Liles, D. Czerwinski, B. Taidi, E. G. Engleman, and R. Levy. 1996. Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells. Nat. Med. 2: 52-58.
- Van Tendeloo, V. F., A. Van de Velde, A. Van Driessche, N. Cools, S. Anguille, K. Ladell, E. Gostick, K. Vermeulen, K. Pieters, G. Nijs, et al. 2010. Induction of complete and molecular remissions in acute myeloid leukemia by Wilms’ tumor 1 antigen-targeted dendritic cell vaccination. Proc. Natl. Acad. Sci. USA 107: 13824-13829.
- Rosenblatt, J., I. Avivi, B. Vasir, L. Uhl, N. C. Munshi, T. Katz, B. R. Dey, P. Somaiya, H. Mills, F. Campigotto, et al. 2013. Vaccination with dendritic cell/ tumor fusions following autologous stem cell transplant induces immunologic and clinical responses in multiple myeloma patients. Clin. Cancer Res. 19: 3640-3648.
- Kantoff, P. W., C. S. Higano, N. D. Shore, E. R. Berger, E. J. Small, D. F. Penson, C. H. Redfern, A. C. Ferrari, R. Dreicer, R. B. Sims, et al; IMPACT Study Investigators. 2010. Sipuleucel-T immunotherapy for castration-resistant proe cancer. N. Engl. J. Med. 363: 411-422.
- Beer, T. M., G. T. Bernstein, J. M. Corman, L. M. Glode, S. J. Hall, W. L. Poll, P. F. Schellhammer, L. A. Jones, Y. Xu, J. W. Kylstra, and M. W. Frohlich. 2011. Randomized trial of autologous cellular immunotherapy with sipuleucel-T in androgen-dependent proe cancer. Clin. Cancer Res. 17: 4558-4567.
- Paczesny, S., J. Banchereau, K. M. Wittkowski, G. Saracino, J. Fay, and A. K. Palucka. 2004. Expansion of melanoma-specific cytolytic CD8+ T cell precursors in patients with ic melanoma vaccinated with CD34+ progenitor-derived dendritic cells. J. Exp. Med. 199: 1503-1511.
- Benitez-Ribas, D., G. J. Adema, G. Winkels, I. S. Klasen, C. J. Punt, C. G. Figdor, and I. J. de Vries. 2006. Plasmacytoid dendritic cells of melanoma patients present exogenous proteins to CD4+ T cells after Fc gamma RII-ted uptake. J. Exp. Med. 203: 1629-1635.
- Radomski, M., H. J. Zeh, H. D. Edington, J. F. Pingpank, L. H. Butterfield, T. L. Whiteside, E. Wieckowski, D. L. Bartlett, and P. Kalinski. 2016. Prolonged intralymphatic delivery of dendritic cells through implantable lymphatic ports in patients with advanced cancer. J. Immunother. Cancer 4: 24.
- Wilgenhof, S., J. Corthals, C. Heirman, N. van Baren, S. Lucas, P. Kvistborg, K. Thielemans, and B. Neyns. 2016. Phase II study of autologous monocyte-derived mRNA electroporated dendritic cells (TriMixDC-MEL) plus ipilimumab in patients with pretreated advanced melanoma. J. Clin. Oncol. 34: 1330-1338.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
