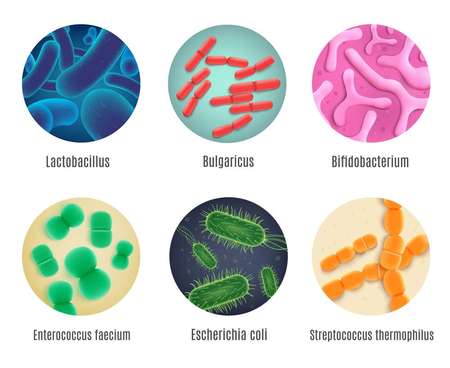
Что такое экзогенная флора в желудке
Относительно недавно в медицинских кругах сложилось утверждение, что человеческим организмом, эмоциями, настроением, здоровьем и поступками правят…бактерии! Место обитания которых – кишечник. Публика мгновенно разделилась на 2 лагеря. Одни утверждают, что бактерии действительно обладают способностью управлять нами, и обосновывают мнение фактами, другие признают это полным антинаучным бредом и, как ни парадоксально, тоже приводят аргументы. Попробуем разобраться и понять, что такое микрофлора, зачем она нужна, как бактерии управляют нами, за что их называют вторым мозгом, и как помочь бактериям сделать управление эффективным.
Что такое микрофлора кишечника
Флора кишечника – это то, что человек получает с момента рождения и развивает на протяжении первых 7-10 лет. Со временем набор микроорганизмов становится разнообразнее и состоит из лактобактерий, бифидобактерий, грибков и кишечных палочек. Все они живут в дружном соседстве не только между собой, но и с патогенной микрофлорой, не позволяя ей размножаться и причинять организму вред.
Считается, что патогенная микрофлора составляет не более 15% от общей массы бактерий. А всего ученые умы насчитывают около 100 триллионов простейших микроорганизмов в нашем кишечнике, вес которых составляет в среднем 1,5 килограмма.
В норме, питанием и образом жизни человек способен длительно поддерживать удачный симбиоз своих поселенцев. Понимание этого процесса поможет значительно повысить качество жизни и здоровья.
За что отвечает микрофлора кишечника
Пищеварение
Одна из важнейших функций кишечных бактерий – участие в процессе переваривания пищи. Это такой гигантский завод по очистке зёрен от плевел. Когда вся поступающая пища, белки, жиры и углеводы расщепляются под воздействием ферментов, работу которых активизирует кишечник. Кишечник – финальная, но самая трудоемкая и времезатратная часть процесса пищеварения. Именно там с помощью микробиома запускается процесс сортировки полезных веществ от ненужного мусора. От того насколько здоров кишечник и весь пищеварительный тракт, зависит и качество сортировки пищи, и количество полезных веществ, которые всасываются и усваиваются именно в кишечнике.
Защита
Один в поле не воин – фраза, которая удачно характеризует работу кишечника. Чем меньше в нём “хороших” бактерий, тем больше места достается “плохим”. Полезные бактерии в процессе жизнедеятельности подавляют рост возбудителей инфекционных заболеваний, поддерживая тем самым защитные функции всего организма.
Иммунитет
Когда защита организма сильна, болезнь не пройдет. И большую роль в этом играет иммунитет, родина которого – кишечник. Как это происходит? Кишечные бактерии стимулируют синтез иммуноглобулинов – особых белков, повышающих защитные силы организма в отношении опасных инфекций. Иммуноглобулины населяют стенки кишечника, при достаточном количестве которых патогенные микроорганизмы не проникают. Также полезные бактерии содействуют созреванию системы фагоцитирующих клеток (неспецифический иммунитет), способных к поглощению и уничтожению патогенных микробов.
Синтез витаминов
Дружественные бактерии, живущие в кишечнике жизненно необходимы человеку для синтеза, хранения и поставки витаминов в организм:
- Витамин В-12
- Фолиевая кислота / Витамин В-9
- Витамин К
- Рибофлавин / Витамин В-2
- Биотин / Витамин В-7
- Никотиновая кислота / Витамин В-3
- Пантотеновая кислота / Витамин В-5
- Пиридоксин / Витамин В-6
- Тиамин / Витамин В-1
Среди них такие, которые нигде больше в организме не вырабатываются. Эта миссия возложена на бактерии. Витамины группы В жизненно необходимы человеку. Они содержат в порядке нервную систему, участвуют в обменных процессах, помогают противостоять стрессам и депрессии. Если нарушена микрофлора, синтез витаминов не происходит должным образом и неприятных последствий не избежать. Кроме того, никакие курсы витаминов не помогут. Вы не ощутите положительный эффект просто потому, что они не будут всасываться в кишечнике.
Как кишечная микрофлора помогает похудеть
Ещё один центр внимания ученых и исследователей – это зависимость веса человека от разнообразия микрофлоры. Так, недавние исследования американских ученых подтвердило этот факт. В ходе эксперимента наборы кишечных бактерий от людей-близнецов поместили в кишечник стерильных мышей. В одном наборе люди-близнецы были худые, в другом страдали ожирением. Микробы, взятые у худых близнецов вызывали похудение у мышей, а бактерии от полных близнецов вызывали у мышей ожирение. Но через время, когда мышей сажали в одну клетку, мыши с ожирением начинали стремительно терять вес.
Ученые сделали предположение, что микрофлора способна управлять пищевыми привычками, требуя от человека тех или иных продуктов, которые будут способствовать росту либо патогенных, либо “худых” бактерий. Лучшим рационом для некоторых бактерий являются жиры и они требуют их постоянно снова и снова, другим жизненно необходим сахар. Именно на зависимости пищевых потребностей и разнообразием бактерий в кишечнике, ученые выдвинули теорию, что кишечные поселенцы, стремятся брать верх над человеком и манипулировать химическим составом среды обитания ради собственных целей и выгоды. Это, в свою очередь, может означать манипуляции нашим поведением (нервничаем, если не едим сладкое, )путем воздействия с помощью нервных импульсов на центры голода, желание съесть тот или иной продукт, к тем или иным продуктам питания, или чувству отвращения от некоторых продуктов.
Почему нарушается баланс микрофлоры
Этот баланс очень хрупок и легко подвержен внешнему влиянию. И происходит это по нескольким причинам:
- прием антибиотиков
- нарушение режима питания
- злоупотребление сахаром и алкоголем
- отравления
- приём некоторых гормональных препаратов
- заболевания пищеварительной системы
- стресс
- приём некоторых лекарств – нестероидных противовоспалительных средств.
Признаки нарушения микрофлоры
- Нарушение стула – запоры, диарея, нерегулярный стул, вздутие, колики, боль
- Нарушения работы ЖКТ – появление тяжести, изжога, отрыжка, увеличение массы тела.
- Обезвоживание – появление ломкости и сухости волос и ногтей, кожных покровов,
- Интоксикация организма – тошнота, болезненный цвет лица, прыщи и угревая сыпь.
- Наличие неприятного запаха при дыхании, неприятный запах фекалий
- Изменения нервной системы – быстрая утомляемость, сонливость, отсутствие настроения, снижение работоспособности.
- Головокружения и головные боли
Как восстановить микрофлору кишечника
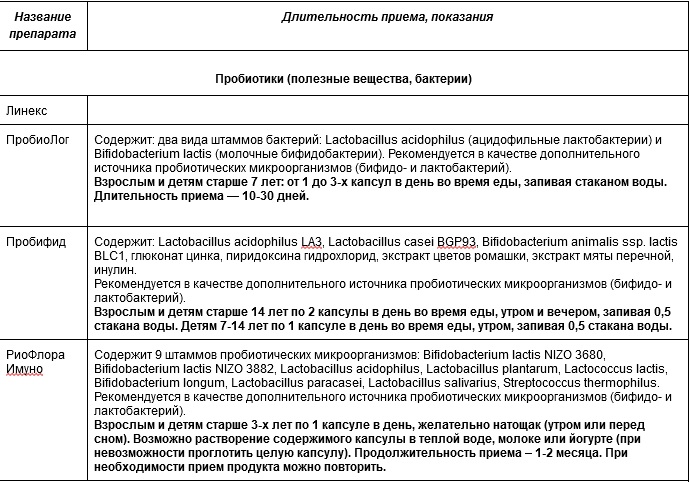
Процесс восстановления микрофлоры не быстрый. Важно не только скорректировать режим питания, но и активно помогать организму “наращивать” микробиом – правильно подобрать нужный препарат, содержащий пре- и пробиотики.
Линекс
Пробиолог
Пробифид


Бонус: могут ли микробы управлять человеческим поведением
Эта гипотеза сейчас становится очень популярной и, действительно, имеет на то ряд прямых и косвенных оснований. Кишечник называют вторым мозгом человека и бактерии, живущие в нем, действительно способны управлять человеком на уровне нервной системы.
В настоящий момент человечеству известно про наш организм многое, но не всё. Исследования в области микрофлоры кишечника и её влиянии на здоровье и качество организма находятся на зачаточной стадии, но привлекает всё больше внимания учёного мира. Так в ходе изучения микробиома человека подтвердилось существование сильной взаимосвязи между состоянием бактерий и работой иммунной, нервной и эндокринной систем. Некоторые ученые полагают, что бактерии могут выделять определенные сигнальные молекулы, влияющие на активность десятичного черепного нерва, проходящего от кишечника к головному мозгу, либо в данном процессе может быть задействован блуждающий нерв.
Сколько времени займет полное познание человека сказать невозможно, но можно быть уверенным, что мы подошли к чрезвычайно важным открытиям, которые, в будущем, решат множество проблем со здоровьем, помогут найти ключ к неизлечимым заболеваниям и тотально изменят привычную жизнь.
Будьте здоровы!
Источник
Ротовая полость и глотка осуществляют предварительную механическую и химическую обработку пищи и дают оценку бактериологической опасности относительно проникающих внутрь человеческого организма бактерий.
Слюна является первой пищеварительной жидкостью, обрабатывающей пищевые вещества и воздействующей на проникающую микрофлору. Общее содержание бактерий в слюне вариабельно и в среднем составляет 108 МК/мл.
В состав нормальной микрофлоры ротовой полости входят стрептококки, стафилококки, лактобациллы, коринебактерии, большое количество анаэробов. Всего микрофлора рта насчитывает более 200 видов микроорганизмов.
На поверхности слизистой в зависимости от применяемых индивидуумом гигиенических средств обнаруживается около 103–105 МК/мм2. Колонизационную резистентность рта осуществляют преимущественно стрептококки (S. salivarus, S. mitis, S. mutans, S. sangius, S. viridans), а также представители кожного и кишечного биотопов. При этом S. salivarus, S. sangius, S. viridans хорошо прилипают к слизистой оболочке и зубному налету. Эти альфа–гемолитические стрептококки, обладающие высокой степенью гистадгезии, сдерживают колонизацию рта грибами рода Сandida и стафилококками.
Микрофлора, транзиторно проходящая через пищевод, нестабильна, гистадгезивности к его стенкам не проявляет и характеризуется обилием временно находящихся видов, попадающих из полости рта и глотки. В желудке создаются относительно неблагоприятные условия для бактерий, обусловленные повышенной кислотностью, воздействием протеолитических ферментов, быстрой моторно–эвакуаторной функцией желудка и другими факторами, лимитирующих их рост и размножение. Здесь микроорганизмы содержатся в количестве, не превышающем 102–104 в 1 мл содержимого. Эубиотики в желудке осваивают в основном полостной биотоп, пристеночный микробиотоп для них менее доступен.
Основными микроорганизмами, активными в желудочной среде, являются кислотоустойчивые представители рода Lactobacillus, обладающие или не обладающие гистадгезивным отношением к муцину, некоторые виды почвенных бактерий и бифидобактерии. Лактобациллы, несмотря на короткое время пребывания в желудке, способны, кроме антибиотического действия в полости желудка, временно колонизировать пристеночный микробиотоп. В результате совместного действия защитных компонентов основная масса попавших в желудок микроорганизмов погибает. Однако при нарушении работы слизистого и иммунобиологического компонентов некоторые бактерии находят в желудке свой биотоп. Так, за счет факторов патогенности в желудочной полости закрепляется популяция Helicobacter pylori.
Немного о кислотности желудка: Максимальная теоретически возможная кислотность в желудке 0,86 рН. Минимальная теоретически возможная кислотность в желудке 8,3 рН. Нормальная кислотность в просвете тела желудка натощак 1,5–2,0 рН. Кислотность на поверхности эпителиального слоя, обращённого в просвет желудка 1,5–2,0 рН. Кислотность в глубине эпителиального слоя желудка около 7,0 рН.
Тонкий кишечник – это трубка около 6м длиной. Она занимает практически всю нижнюю часть брюшной полости и является самой длинной частью пищеварительной системы, соединяюще желудок с толстым кишечником. Большая часть пищи уже переваривается в тонком кишечнике с помощью специальных веществ – энзимов (ферментов).
К основным функциям тонкой кишки относят полостной и пристеночный гидролиз пищи, всасывание, секрецию, а также барьерно–защитную. В последней, кроме химических, ферментативных и механических факторов, значительную роль играет индигенная микрофлора тонкой кишки. Она принимает активное участие в полостном и пристеночном гидролизе, а также в процессах всасывания пищевых веществ. Тонкая кишка является одним из важнейших звеньев, обеспечивающих длительное сохранение эубиотической пристеночной микрофлоры.
Существует разница в заселении эубиотической микрофлорой полостного и пристеночного микробиотопов, а также заселении ярусов по длине кишки. Полостной микробиотоп подвержен колебаниям по составу и концентрации микробных популяций, пристеночный микробиотоп имеет сравнительно стабильный гомеостаз. В толще слизистых наложений сохраняются популяции, обладающие гистадгезивными свойствами к муцину.
Проксимальный отдел тонкой кишки в норме содержит относительно небольшое количество грамположительной флоры, состоящей главным образом из лактобацилл, стрептококков и грибов. Концентрация микроорганизмов составляет 102–104 на 1 мл кишечного содержимого. По мере приближения к дистальным отделам тонкой кишки общее количество бактерий возрастает до 108 на 1 мл содержимого, одновременно появляются дополнительные виды, включающие энтеробактерии, бактероиды, бифидобактерии.
ВНИМАНИЕ: Пробиотические препараты компании «Экобиос» – имеют высокую эффективность в борьбе с дисбактериозом кишечника человека!
Источник
При
нормальном функционировании желудка
микрофлора в нем почти отсутствует,
вследствие кислой реакции желудочного
сока и высокой активности гидролитических
ферментов. Поэтому в желудке могут быть
обнаружены в небольшом количестве
кислотоустойчивые виды – лактобактерии,
дрожжи, Sarcientriculiи др (106-107клеток на 1 мл
содержимого).
В
двенадцатиперстной и верхних отделах
тонкой кишки микроорганизмов встречается
мало, несмотря на то, что кислая среда
желудка сменяется щелочной. Это
объясняется неблагоприятным воздействием
на микробы присутствующих здесь
ферментов. Тут обнаруживаются энтерококки,
молочнокислые бактерии, грибы, дифтероиды
(106клеток на 1 мл содержимого). В
нижних отделах тонкой кишки, постепенно
обогащаясь, микрофлора сближается с
микрофлорой толстой кишки.
Микрофлора
толстой кишки наиболее разнообразна
по числу видов (более 200 видов) и количеству
обнаруживаемых микробов (109-1011клеток на 1 мл содержимого). Микробы
составляют 1/3 сухой массы фекалий.
Облигатная
микрофлора представлена анаэробными
(бактероиды, бифидумбактерии, вейлонеллы)
бактериями (96-99%) и факультативными
анаэробами (E.coli,
энтерококки, лактобациллы – 1-4%).
Транзиторная
микрофлора представлена следующими
родами и видами: протей, клебсиеллы,
клостридии, синегнойная палочка,
кампилобактер, дрожжеподобные грибы
рода Candidaи др. Микроорганизмы
родаCampylobacter(C.fennelliae,C.cinaedi,C.hyointestinalis) встречаются в
толстом кишечнике человека при
иммунодефицитных состояниях различной
природы.
Состав
микрофлоры кишечника меняется в течение
жизни человека.
У
новорожденных в первые часы после
рождения меконий стерилен – асептическая
фаза. Вторая фаза – фаза возрастающей
обсемененности (первые три дня жизни
ребенка). В этот период в кишечнике
преобладают эшерихии, стафилококки,
энтерококки, дрожжеподобные грибы.
Третья фаза – фаза трансформации флоры
кишечника (начиная с 4 дня жизни).
Устанавливается молочнокислая микрофлора,
лактобактерии, ацидофильные бактерии.
После
окончания грудного вскармливания
начинает постепенно формироваться
постоянный биоценоз в пищеварительном
тракте.
В
микрофлоре желудочно-кишечного тракта
различают мукозную (М) и просветную (П)
микрофлору, состав которой различен.
М-флора тесно ассоциирована со слизистой
оболочкой, более стабильна и представлена
бифидумбактериями и лактобактериями.
М-флора препятствует пенетрации слизистой
оболочки патогенными и условно-патогенными
микроорганизмами. П-флора наряду с
бифидум- и лактобактериями включает и
других постоянных обитателей кишечника.
Для
изучения микрофлоры толстого кишечника
исследованию подвергают испражнения,
которые забирают стерильной деревянной
или стеклянной палочкой и помещают в
пробирку с консервантом. Материал
доставляют в лабораторию в течение 1
часа, так как при более длительном
хранении значительно нарушаются
взаимоотношения между видами.
Проводят
микроскопическое исследование мазков
и фекалий, окрашенных по Граму, а так же
производят посев испражнений на
питательные среды: Эндо, кровяной агар,
молочно-солевой агар, агар Сабуро. Посев
производят с таким расчетом, чтобы можно
было подсчитать количество колоний с
различной характеристикой и определить
число микробных клеток разных видов
микроорганизмов в данной пробе. При
необходимости проводят биохимическую
идентификацию и серологическое
типирование видов.
Соседние файлы в предмете Микробиология
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Определите значение слов,
и вы избавите свет от половины его заблуждений.
Декарт
Афоризм, вынесенный в эпиграф данной статьи, как нельзя лучше отражает состояние проблемы по дисбиозам, поскольку до сих пор остается множество вопросов. Врачи нередко используют в качестве синонимов термины «дисбактериоз», «дисбиоз», «микроэкология кишечника», «микробиоценоз кишечника», которые, в строго научном плане, не эквивалентны. Принципиальный вопрос даже не в используемых терминах, а в понимании сути проблемы и ее общебиологического значения. Его решение позволит более обоснованно и нацеленно проводить терапию, направленную на коррекцию микробиоценоза.
Общие представления о нормальном микробиоценозе ЖКТ
ЖКТ представляет собой одну из наиболее сложных микроэкологических сред организма человека, в которой на суммарной площади слизистой оболочки, составляющей около 400 м2, имеется исключительно высокая и разнообразная (свыше 500 видов) плотность микробной обсемененности, в которой очень тонко сбалансировано взаимодействие между защитными системами макроорганизма и микробными ассоциациями [12]. Как полагают, бактерии составляют от 35 до 50% объема содержимого ободочной кишки человека, а их совокупная биомасса в ЖКТ приближается к 1,5 кг [13].
Однако бактерии неравномерно распределены в ЖКТ. Если в желудке плотность микробной колонизации невелика и составляет всего около 103–104 КОЕ/мл, а в подвздошной кишке — 107–108 КОЕ/мл, то уже в области илеоцекального клапана в ободочной кишке градиент плотности бактерий достигает 1011–1012 КОЕ/мл [15]. Несмотря на столь обширное разнообразие видов бактерий, обитающих в ЖКТ, большинство могут идентифицироваться только молекулярно-генетически [13].
Среди бактерий-комменсалов, культивированных из ЖКТ, более 99,9% являются облигатными анаэробами, из которых доминирующими представителями являются: Bacteroides, Bifidobacterium, Eubacterium, Lactobacillus, Clostridium, Fusobacterium, Peptococcus, Peptostreptococcus, Escherichia и Veillonella [16]. Состав обнаруживаемых бактерий в различных отделах ЖКТ весьма вариабелен. В зависимости от частоты и постоянства обнаружения бактерий, вся микрофлора подразделяется на три группы (табл. 1).
Индивидуальность и стабильность микробиоценоза ЖКТ в физиологических условиях у человека является одной из характерных черт. Механизмы поддержания стабильности качественных и количественных параметров индигенной микрофлоры, несмотря на перманентное поступление экзогенных микроорганизмов с водой и пищей, пока до конца не выяснены. Среди ведущих факторов, обеспечивающих такую стабильность, традиционно рассматривают естественные природные защитные системы, которые обеспечивают в том числе и неспецифическую противоинфекционную резистентность (табл. 2).
Хотя структурно-функциональное значение этих систем в обеспечении стабильности микробиоценоза изучено не в равной степени, имеющиеся клинические наблюдения наглядно свидетельствуют о том, что нарушения их функциональной активности закономерно сопровождаются изменением состава флоры. Особенно велико влияние нормальной кислотности желудочного сока, обеспечивающего минимальное поступление экзогенных микроорганизмов в тонкую кишку [17].
Кроме этого, развитие концепции микробного сообщества (микробиоты) подразумевает наличие между микроорганизмами регуляторных влияний, позволяющих им координированно участвовать в процессах, происходящих в определенных биотопах (в частности, в ЖКТ). Одним из ключевых механизмов межклеточного взаимодействия между бактериями является механизм quorum sensing («чувство кворума»), впервые описанный в 1999 г. [18], но фактически совершенно не изученный в индигенной микрофлоре ЖКТ.
Клинические аспекты нарушений микробиоценоза ЖКТ
Современные исследования свидетельствуют, что облигатная микрофлора ЖКТ непосредственно участвует во многих жизненно важных процессах макроорганизма внутри самого пищеварительного тракта, а также оказывает многочисленные и разнообразные системные регулирующие функции, в силу чего индигенную микрофлору (нормальный микробиоценоз) кишечника нередко рассматривают в качестве составной части макроорганизма или как экстракорпоральный орган (табл. 3).
Нарушение микробиоценоза ЖКТ, характеризующееся снижением качественных и количественных показателей облигатной и факультативной микрофлоры, способно оказывать и негативное влияние на здоровье человека. Помимо «выпадения» физиологических функций, связанных со снижением плотности присутствия индигенной микрофлоры, развитие дисбиоза может быть сопряжено: а) с транслокацией бактерий и развитием эндогенных инфекционных процессов (вплоть до гнойно-септических состояний); б) со снижением резистентности организма; в) с развитием аллергических и иммунопатологических состояний; г) формированием патогенных клонов бактерий, обусловленным обилием в просвете кишечника плазмидных и хромосомных генов.
Принципы коррекции дисбиотических нарушений ЖКТ
Проблема изучения микробиоценоза ЖКТ сводится к попыткам его коррекции с помощью микробиологических препаратов. Эти попытки предпринимались и на заре изучения данной проблемы (Л. Г. Перетц), и с нарастающей интенсивностью продолжаются сейчас. На сегодняшний день накоплен обширный опыт применения пробиотиков. Обычно их используют в качестве профилактических препаратов и с целью коррекции дисбиотических нарушений. Однако имеется немало статей, в которых описывают и их терапевтический эффект при ряде патологических состояний [19–24].
Поскольку развитие дисбиоза характеризуется не банальным дефицитом представителей облигатной и/или факультативной микрофлоры, а является индикатором, свидетельствующим о нарушении микроэкосистемы, простого назначения пробиотиков с целью коррекции микробиоценоза бывает явно недостаточно. Главной целью врача должно стать не «засевание» слизистой кишечника пациентов нормальной микрофлорой, а восстановление микробиоценоза ЖКТ и плотности колонизации индигенной микрофлоры. Достижение данной цели возможно:
- благодаря диетотерапии;
- устранению действия экзо- и эндогенных факторов, вызвавших и поддерживающих нарушение микробиоценоза (хронические воспалительные процессы различной локализации, образ жизни и характер питания, онкологические заболевания и т. д.);
- ограничению колонизации слизистой ЖКТ условно-патогенной микрофлорой (селективная деконтаминация);
- абсорбции и удалению токсических веществ из просвета ЖКТ;
- восстановлению функциональной активности органов ЖКТ (кислотность желудочного сока, моторно-эвакуаторная активность кишечника; оптимизация функции гепатобилиарной системы и т. д.);
- назначению биопрепаратов (про-, пре- и синбиотиков), создающих и поддерживающих оптимальные условия, способствующие восстановлению микробиоценоза и оказывающих заместительные функции.
Пребиотики представляют собой химические компоненты (микробного и немикробного происхождения), способные избирательно стимулировать рост и/или метаболическую активность одной или нескольких групп бактерий, входящих в состав нормальной индигенной микрофлоры. Комбинированные препараты, в состав которых входят бактерийные препараты и стимуляторы роста, обозначают как синбиотики.
Согласно современным представлениям [10], штаммы, используемые в качестве пробиотиков, должны отвечать следующим критериям: а) быть безопасносными для человека; б) быть резистентными к действию кислого содержимого желудка, желчи и ферментам поджелудочной железы; в) обладать выраженными адгезивными свойствами в отношении эпителиальных клеток слизистой оболочки ЖКТ; г) проявлять антимикробную активность; д) ингибировать адгезию патогенных бактерий; е) быть резистентными к действию антибиотиков; ж) сохранять стабильность при хранении препарата.
Наиболее часто в качестве пробиотиков используют различные виды лакто- и бифидобактерий (табл. 4).
Предпочтение, отдаваемое препаратам, содержащим молочнокислые бактерии Lactobacillus spp. и Bifidobacterium spp., обусловлено тем, что они резистентны к действию желудочного сока, желчи и ферментам поджелудочной железы, легко адгезируются и колонизируют слизистую оболочку кишечника.
В целях повышения клинической эффективности пробиотиков в настоящее время предпочтение отдается разработке и использованию комплексных препаратов, в состав которых входит несколько штаммов бифидо- и лактобактерий, витаминные комплексы, пектины, что, как полагают, способствует повышению их адгезивности и колонизации слизистой оболочки кишечника. Капсульные формы также имеют определенные преимущества как в стабильности препарата, так и в сохранении активности штамма при прохождении через кислотный барьер желудка.
К таким препаратам относятся Линекс, Бификол, Ацилакт, Аципол, Бифистим и др. Длительность курса лечения пробиотиками обычно составляет от 2 нед до 1–2 мес. Прием пробиотиков целесообразно сочетать с употреблением щелочных растворов (столовые минеральные воды).
Клиническая эффективность пробиотиков связана с колонизацией слизистой оболочки кишечника и заместительным восстановлением функций нормальной индигенной микрофлоры кишечника (табл. 3), что обеспечивает создание микроэкологической среды, способствующей восстановлению индигенной микрофлоры. Хотя штаммы бактерий, используемые в производстве пробиотиков, отобраны из состава микрофлоры ЖКТ человека, они все же не обладают длительной колонизационной резистентностью и элиминируются из кишечника в течение 3–7 нед.
В последние годы широкое распространение в качестве пробиотиков получил препарат Энтерол, в состав которого входят дрожжи Saccharomyces boulardii. Данные дрожжи не входят в состав нормальной индигенной микрофлоры ЖКТ, однако обладают выраженными антагонистическими свойствами в отношении широкого спектра патогенных и условно-патогенных бактерий, сохраняют жизнеспособность при транзите по ЖКТ, абсолютно резистентны к действию любых антибактериальных препаратов (чувствительны только к противогрибковым препаратам). Спектр их ферментативной активности, по данным современных исследований, обеспечивает им участие в процессах пищеварения и обмена веществ. Saccharomyces boulardii относят к самоэлиминирующимся штаммам, поскольку их элиминация происходит в течение 3–4 дней после прекращения приема препарата. Обычный курс лечения Энтеролом составляет 7–10 дней.
Все большее внимание при восстановлении микробиоценоза кишечника уделяется относительно новому классу препаратов — пребиотикам, важнейшим требованием к которым является селективность действия только на индигенную микрофлору без усиления роста и размножения токсинпродуцирующих клостридий, токсигенных штаммов кишечной палочки и протеолитических бактероидов. Использование этих препаратов возможно только в случае доминирования в составе индигенной микрофлоры кишечника бифидо- и лактобактерий.
Наиболее часто используемыми пребиотиками являются Хилак форте и различные препараты пищевых волокон (кукурузные хлопья, крупы, хлеб).
Хилак форте содержит субстраты продуктов обмена индигенной микрофлоры кишечника, способствующих регенерации эпителиальных клеток слизистой оболочки кишечника и быстрому восстановлению нормофлоры. Препарат обычно назначают по 40–60 капель 3 раза в день в небольшом количестве жидкости (за исключением молока). Дозы и длительность приема препарата определяются индивидуально.
Клиническая эффективность комбинированных препаратов пробиотиков и пребиотиков (синбиотиков) пока остается малоизученной ввиду недостаточно накопленного опыта.
Вопросы безопасности использования пробиотиков
Длительный опыт клинического применения пробиотиков способствовал распространению и укреплению мнения их безопасности. Однако публикуемые в медицинской печати (особенно в последние годы) данные клинических наблюдений свидетельствуют о необходимости более глубокого анализа вопросов безопасности применения пробиотиков [32].
В настоящее время полагают, что оральный прием живых бактерий теоретически может быть ответственен за четыре типа побочных эффектов: а) развитие инфекционных процессов, обусловленных штаммами, входящими в состав пробиотиков; б) развитие метаболических расстройств; в) чрезмерная иммуностимуляция лимфатического аппарата кишечника; г) формирование новых клонов бактериальных штаммов за счет передачи генов, ответственных за экспрессию факторов патогенности.
Наибольшую настороженность вызывает возможность развития инфекционных процессов. Поскольку пробиотические штаммы бактерий отобраны из числа представителей индигенной микрофлоры, риск развития инфекционных процессов оценивается как очень низкий, но возможный. Данный тезис подкреплен целым рядом клинических наблюдений и обзорных статей, в которых описываются случаи развития бессимптомной бактериемии, тяжелого сепсиса, эндокардита, пневмонии и абсцессов, вызванных лакто-, бифидо- или другими бактериями [33, 34]. Поступление бактерий в кровоток возможен вследствие их транслокации через слизистую оболочку кишечника. Чаще всего факторами риска, связанными с бактериемией Lactobacillus, являются патологические процессы ЖКТ, обусловливающие снижение защитных барьерных функций, повышающих проницаемость слизистых оболочек кишечника (опухоли ЖКТ, травмы, операции) и иммуносупрессивные состояния.
Многие авторы отмечают, что бактериемию Lactobacillus очень трудно диагностировать, поскольку данный тип бактерий тяжело культивировать и идентифицировать, а в тех случаях, когда получают рост, это нередко расценивается как контаминация. Наиболее часто инфекционные процессы были обусловлены Lactobacillus rhamnosus, Lactobacillus fermentum и Lactobacillus casei.
Enterococcus faecium и E. faecalis тоже могут обусловить развитие инфекционных процессов. Кроме этого, уже имеются указания на появление ванкомицин-устойчивых штаммов энтерококков.
Определенное беспокойство вызывает и широкое применение препаратов, содержащих дрожжи — Saccharomyces boulardii, что связано с диагностируемой фунгемией [35]. Большинство исследователей отмечают, что развитие фунгемии обусловлено воздействием Saccharomyces boulardii на сосудистые катетеры.
Итак, дисбиотические нарушения ЖКТ — актуальная проблема практического здравоохранения, требующая глубокого теоретического, экспериментального и клинического исследования. Несмотря на то, что применение пробиотиков и является важной составной частью коррекции микробиоценоза, оно не должно являться самоцелью.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
Н. М. Гюлазян, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Источник