Атрофический гастрит рак желудка
Рак желудка – одно из самых распространенных злокачественных заболеваний в мире, где оно занимает 5 место в структуре онкологических болезней и 2 место в структуре смертности от онкопатологии. В России рак желудка занимает пятое место в структуре заболеваемости злокачественными новообразованиями у мужчин и шестое место – у женщин.
Широкая распространенность этой болезни и низкий процент пятилетней выживаемости (в среднем по миру 10-20%) заставляет специалистов по всему миру активно искать алгоритмы своевременной диагностики не столько рака желудка, сколько предраковых заболеваний.
С учетом локализации поражения принято выделять два основных типа рака желудка: кардиальный (поражение кардиального отдела) и некардиальный рак (тело и/или выходной отдел желудка).
Хронический гастрит – маленький шаг на пути к раку желудка
Такое пугающее название подзаголовка достаточно точно отражает текущее понимание этапов развития рака желудка. Само заболевание «хронический гастрит» обычно не вызывает явных симптомов. А вот наличие типичных проявлений болезни, таких как боли в животе, чувство тяжести, переполнения после еды, тошнота – это симптомы функциональной диспепсии, до сих пор неверно определяемой не только пациентами, но даже врачами-гастроэнтерологами как хронический гастрит.
Итак, хронический гастрит – заболевание, которое не проявляется симптомами, а диагноз подтверждается только на основании гистологического исследования биоптатов желудка. Врач-морфолог, выполняющий исследование, может выявить воспаление в слизистой оболочке различной степени выраженности. Это и есть хронический гастрит.
У определенной части лиц длительное воспаление в слизистой желудка (хронический неатрофический гастрит) может привести к развитию атрофических изменений, а иногда клетки желудка могут замещаться нетипичными кишечными клетками (так называемая кишечная метаплазия).
Кишечная метаплазия повышает риск развития дисплазии – предракового заболевания, которое со временем может трансформироваться в аденокарциному (рак) желудка.
Эти этапы, сменяющие друг друга, – хронический гастрит без атрофии, атрофический гастрит, кишечная метаплазия, дисплазия, рак желудка – получили название «каскад Корреа» по имени автора, который описал данную последовательность.

Причины хронического гастрита
Поскольку воспалительные изменения в слизистой желудка, т.е. гастрит – начальные этапы развития рака желудка, попробуем разобраться, откуда же возникает это заболевание. Давно уже доказано, что нерегулярное питание, еда всухомятку и другие нарушения режима приема пищи не вызывают гастрит. Скорее, эти факторы могут способствовать обострению функциональной диспепсии. Тогда что же, образно выражаясь, подкидывает дрова в топку воспаления в слизистой оболочке желудка?
На сегодняшний день выделено несколько факторов, которые доказано вызывают развитие воспаления в желудке:
- инфекция, прежде всего инфекция Helicobacter pylori (H.pylori);
- аутоиммунное воспаление;
- воспаление в ответ на химическое повреждение (например, желчью при дуодено-гастральном рефлюксе).
Конечно, существуют и другие причины, но их вклад в развитие воспаления в желудке можно считать незначительным.
Инфекция H.pylori в настоящее время рассматривается как основной фактор, вызывающий развитие хронического гастрита. Около 44% населения земного шара инфицированы этим возбудителем. Известно, что распространенность атрофического гастрита на фоне инфекции H.pylori риска варьирует от 8% в Западных странах до 84% в Японии и Китае. H.pylori считается наиболее значимым фактором риска развития некардиального рака желудка.
Аутоиммунное воспаление встречается намного реже, однако также приводит к развитию хронического гастрита, нередко с атрофией, и ассоциировано с повышенным риском развития рака желудка.
Факторы риска развития аденокарциномы (рака) желудка
1) Наследственная предрасположенность.
Известно, что риск развития рака желудка у родственников первой степени родства (родители, дети) повышен в 2,3-3,5 раза. При указании на 2 и более случаев рака желудка у ближайших родственников этот риск возрастает в 5-12 раз. Риск выше в тех случаях, когда онкопатология желудка была выявлена у родственников в возрасте менее 50 лет.
2) Аутоиммунное поражение желудка с развитием пернициозной (В12-дефицитной) анемии.
Для аутоиммунного поражения желудка помимо развития атрофии характерно также разрушение внутреннего фактора (фактора Кастла), который обеспечивает нормальное всасывание витамина В12 в тонкой кишке. Установлено, что аутоиммунный гастрит повышает риск развития аденокарциномы (рака) желудка в 2-6,8 раз.
3) Этнические факторы.
Установлено, что риск развития рака желудка выше у азиатов по сравнению с белыми (в 2,1 раза) и лицами негроидной расы (в 1,7 раза). Среди лиц азиатской расы наибольший риск отмечен у китайцев (4,77) и корейцев (7,39). Нельзя исключить, что такое различие обусловлено в том числе высокой частотой инфекции H.pylori у этих лиц и генетическими особенностями.
4) Старший возраст.
Существуют доказательства того, что в разных возрастных группах риск развития рака желудка различается. «Пограничным» считается возраст старше 45 лет, после которого риск развития заболевания повышается в 1,92-3,1 раза. Вероятнее всего, такая взаимосвязь обусловлена длительностью инфицирования H.pylori и возникшего на этом фоне хронического воспаления
5) Мужской пол.
По данным исследований мужчины имеют больший риск развития аденокарциномы (рака) желудка по равнению с женщинами, при этом риск повышен в 1,3-3 раза.
6) Табакокурение.
Курильщики имеют повышенный риск развития рака желудка, локализованного в кардиальном отделе. Вероятность развития заболевания увеличивается в 1,45-2 раза по данным разных исследований.
7) Инфекция H.pylori.
По всей видимости, это наиболее «весомый» фактор риска развития рака желудка, учитывая широкую распространенность этой инфекции по всему миру. Исследования показали, что риск развития некардиального рака желудка у инфицированных лиц увеличен в 12 раз. Примерно у 1% из них в течение жизни развивается аденокарцинома желудка. Риск развития рака кардиального отдела желудка не повышается.
8) Полипы желудка.
Полипы желудка делятся на 3 вида: полипы фундальных желез, гиперпластические полипы и аденоматозные полипы. В полипах фундальных желез размерами более 1 см редко, но выявляет дисплазия и рак (с частотой по 1,9%, соответственно). Для гиперпластических полипов больших (>1 см) размеров характерно нередкое выявление дисплазии (1,9-19%) и, реже злокачественное перерождение (0,6-2,1%). Аденоматозные полипы значительно повышают риск развития аденокарциномы желудка, а при размерах полипов >2 см частота выявления в них аденокарцином достигает по некоторым данным 50%.
9) Атрофический гастрит.
Поскольку атрофический гастрит является одним из этапов в «каскаде Корреа» (см.выше), проводилась оценка риска его трансформации в рак желудка. Согласно современным данным, ежегодный риск перехода атрофического гастрита в рак желудка составляет 0,1-1,2%. Частота выявления рака желудка у пациентов с атрофией в течение 5 лет варьирует от 0,7% (для слабо выраженной атрофии) до 10% (тяжелая атрофия).
10) Кишечная метаплазия.
Как и атрофический гастрит, кишечная метаплазия является одним из этапов «каскада Корреа» на пути к развитию рака желудка. Ежегодный риск перехода кишечной метаплазии в рак желудка составляет 0,25-0,4%. Частота выявления рака желудка у пациентов с кишечной метаплазией в течение 5 лет составляет 5,3-9,8%.
11) Дисплазия.
Дисплазия (предраковое состояние) делится на два типа: низкой и высокой степени. Дисплазия низкой степени имеет ежегодный риск трансформации в рак желудка 0,6%, в то время как для высокой степени – 6%.
Частота выявления рака желудка у пациентов с дисплазией низкой степени в течение 5 лет составляет 0-23%, высокой степени – 60-85%.
Рекомендации по профилактике развития аденокарциномы (рака) желудка
В течение 2019 года были опубликованы рекомендации по диагностике и лечению пациентов с высоким риском аденокарциномы (рака) желудка сразу двумя группами авторов: Британским обществом гастроэнтерологов и коллегией ученых, представленных членами Европейского общества гастроинтестинальной эндоскопии, Европейской группы по изучению Helicobacter pylori и микробиоты, Европейского общества патологов и Португальского общества гастроинтестинальной эндоскопии (т.н. международные рекомендации по лечению предраковых состояний и изменений желудка второго пересмотра (MAPS II). Были даны рекомендации по недопущению развития и своевременному выявлению грозной болезни – рака желудка.
Итак, каковы же рекомендации в отношении профилактики развития рака желудка?
1) Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития рака желудка.
Комментарий: Наибольший риск отмечается при выявлении атрофии/кишечной метаплазии одновременно в антральном отделе и теле желудка.
2) Лица, проживающие в регионах с высокой частотой рака желудка должны быть тестированы на инфекцию H.pylori.
Комментарий: следует использовать достоверные методы диагностики, включающие дыхательный тест с С13 меченой мочевиной, определение антигена H.pylori в кале или антител к H.pylori класса IgG в крови. Россия относится к регионам с высокой распространенностью рака желудка.
3) Лицам без симптомов в возрасте ≥50 лет с множественными факторами риска (мужской пол, курение табака, наследственность по раку желудка и т.д.) следует проводить скрининговую гастроскопию.
Примечание: скрининг в медицине – это комплекс мероприятий, направленных на выявление заболевания, которое себя никак не проявляет. В данном случае речь идет о проведении гастроскопии лицам без симптомов рака желудка.
Очень важно! Существует несколько видов наследственного рака желудка, для которого характерно более раннее появление (в возрасте до 40 лет).
4) Лицам с высоким риском развития рака желудка (включая гастрит с атрофией и кишечной метаплазией) необходимо проведение регулярной гастроскопии с фотофиксацией и гистологическим исследованием.
Комментарий: согласно данным зарубежных исследований, рак желудка оказывается невыявленным при проведении гастроскопии в 6-11% случаев. Очень важной является медленный осмотр слизистой оболочки желудка и фиксация изображений (фотографии, видеозапись), что позволяет увеличить выявление раннего рака желудка. В клинике «Эксперт» ведется видеозапись всех эндоскопических исследований желудочно-кишечного тракта на обязательной основе.
5) Пациентам с распространенной атрофией и кишечной метаплазией (вовлечение антрального отдела и тела желудка) показана регулярная гастроскопия с биопсией.
Комментарий: частота гастроскопий зависит от многих факторов, включая случаи рака желудка в семье, сохранение инфекции H.pylori, несмотря на адекватное лечение, и т.д.
6) Лицам, имеющим хронический гастрит или гастрит с атрофией на фоне H.pylori, должна быть проведена эрадикационная терапия инфекции.
Комментарий: профилактика развития рака желудка наиболее эффективна в тех случаях, когда пациента начинали лечить от инфекции H.pylori на этапе выявления неатрофического гастрита или гастрита с атрофией.
7) Лечение инфекции H.pylori может быть эффективной мерой в отношении профилактики развития рака желудка у части пациентов, которые уже имеют кишечную метаплазию, дисплазию или рак желудка.
Комментарий: лечение инфекции H.pylori у пациентов с кишечной метаплазией и дисплазией, а также у лиц с удаленной эндоскопическим методом аденокарциномой желудка снижает риск развития/повторного развития рака желудка. Однако профилактический эффект от лечения на этих этапах меньший, чем при хроническом неатрофическом или атрофическом гастрите.
Заключение
Своевременная и адекватная по объему диагностика на этапе «простого гастрита», т.е. до развития атрофии/метаплазии/дисплазии позволяет определиться с рисками развития онкопатологии желудка, подобрать верную тактику, позволяющую избежать развития грозного заболевания.
Источник
Когда гастроэнтерологи говорят, что атрофический гастрит – это предраковое состояние, они не нагнетают. Это действительно самая опасная разновидность гастрита: риск развития рака желудка в 5 раза выше, чем при гастрите без атрофии. По данным Всемирной организации здравоохранения, в 13% случаев атрофический гастрит заканчивается онкологией. Что такое атрофия, откуда она берётся и при каких условиях трансформируется в рак, рассказываем далее.
Откуда берётся атрофия
Если говорить о слове «атрофия» в общем, то это процесс, при котором снижается или полностью прекращается функция какого-либо органа. Гастрит – воспалительное заболевание желудка. Когда воспаление сопровождается отмиранием обкладочных желез (они вырабатывают желудочный сок), гастрит классифицируют как атрофический.
Атрофия обычно развивается на фоне длительно существующей хеликобактерной инфекции, которая сопровождается аутоиммунным процессом: собственные антитела организма «набрасываются» на клетки обкладочных желез желудка и повреждают их. Возникновению атрофического гастрита также способствует стресс, злоупотребление алкоголем, бесконтрольный приём лекарств, другие заболевания.
Примерно у половины пациентов с гастритом, вызванным Helicobacter pylori (он является причиной 90% случаев гастрита), развивается атрофия.
Гастроэнтерологи называют атрофический гастрит предраковым состоянием. Для того, чтобы развился рак желудка (аденокарцинома желудка) требуются годы, но, если человек не испытывает тяжёлых симптомов (так часто и бывает), онкология становится более чем реальной.
По данным Всемирной организации здравоохранения, рак желудка занимает шестое место по распространённости на Земле и третье по смертности. Ежегодно от него погибает около 800 тысяч человек.
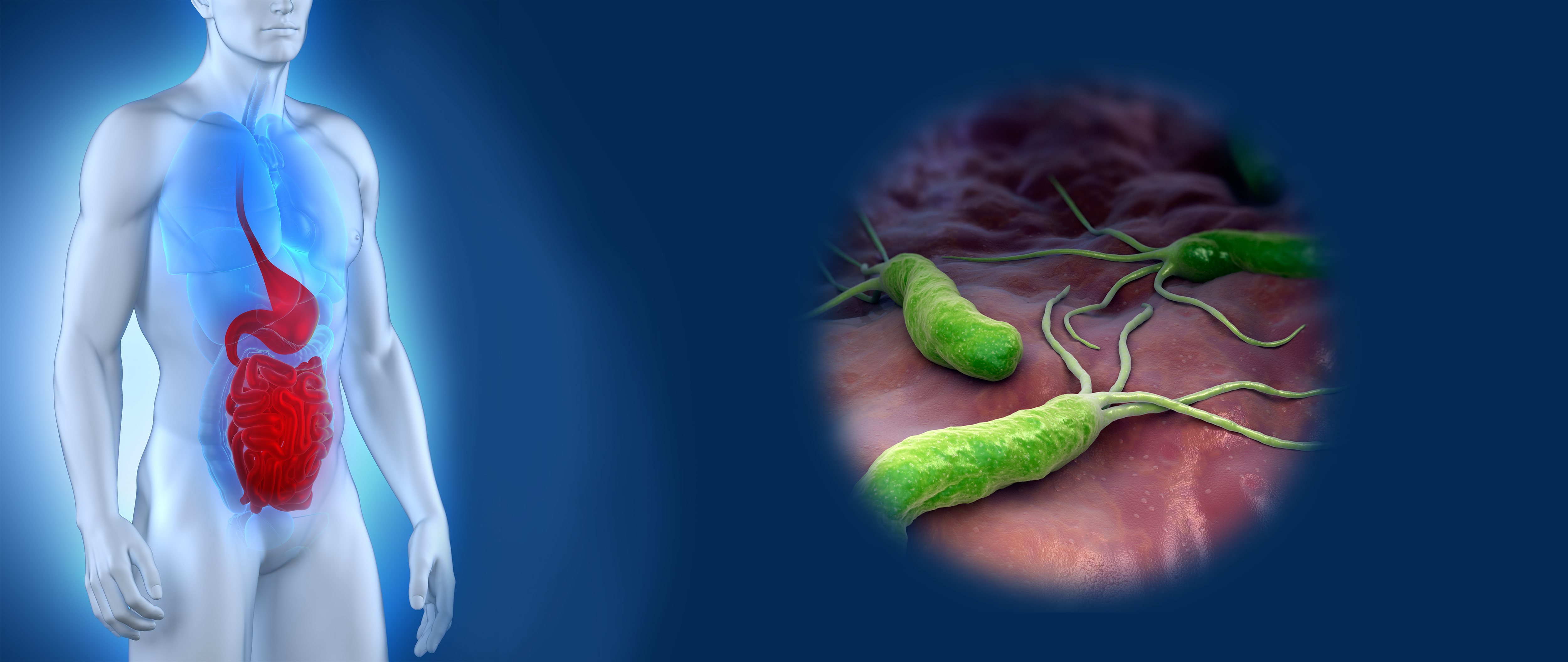
Как Helicobacter pylori «проедает» слизистую?
Желудок выстлан слизистой оболочкой, которая защищает его от соляной кислоты, опасных бактерий и токсинов. Helicobacter pylori атакует слизистую, ослабляет её защитные свойства, делает проницаемой и подверженной воздействию агрессивных факторов. Это вызывает нарушения в работе пищеварительной системы и всего организма в целом.
Далее под воздействием Helicobacter pylori и аутоиммунных изменений ткани желудка начинают перерождаться в кишечные. Этот процесс называется кишечной метаплазией. Чем дальше зашла метаплазия, тем больше вероятность развития рака желудка.
Площадь атрофии – основной показатель риска рака желудка. Если метаплазия распространена на 20% слизистой, то вероятность онкологии достигает почти 100%. По статистике, 13% случаев хронического атрофического гастрита заканчиваются злокачественной опухолью.
Как вылечить атрофический гастрит?
Успешность лечения напрямую зависит от запущенности атрофического гастрита. Но в любом случае, лучше обнаружить это заболевание, чем рак. Полное восстановление структуры слизистой оболочки при тяжелой атрофии требует очень длительного времени, в ряде случаев это вообще невозможно. Поэтому больные с таким диагнозом обязаны постоянно соблюдать диету, принимать определённые лекарства и наблюдаться у врача.
Основные шаги лечения:
- Восстановление слизистой оболочки – это главное, к чему нужно стремиться пациенту с атрофическим гастритом. Поэтому гастроэнтеропротектор (ребамипид) необходим на всех этапах лечения. Он защищает слизистую и помогает ей вернуть целостность;
- Уничтожение бактерии Helicobacter pylori обязательно, без этого развитие атрофического гастрита не остановить. Сейчас врачи назначают два антибиотика и антисекреторный препарат (ИПП);
- Нормализация моторики желудочно-кишечного тракта при помощи прокинетиков (итомед) – пища не будет застаиваться в желудке;
- Лечебная диета Стол №1 или Стол №5. Главные принципы – химически, термически и механически щадящая пища;
- При пониженной кислотности желудка необходимы препараты для повышения секреции соляной кислоты, при повышенной кислотности – наоборот, антисекреторные препараты.
Пациентам с атрофическим гастритом даже при соблюдении всех рекомендаций необходимо регулярно обследовать желудок и кишечник (потому что органы взаимосвязаны). Ежегодная диагностика включает гастроскопию, гастропанель (она позволяет оценить площадь атрофии) и анализ на Helicobacter pylori. Колоноскопию при отсутствии болезненных симптомов со стороны кишечника достаточно делать раз в пять лет. Правда, это показано даже здоровым людям после 50 лет, потому что в этом возрасте велик риск развития рака кишечника.
Обращаем ваше внимание! Эта статья не является призывом к самолечению. Она написана и опубликована для повышения уровня знаний читателя о своём здоровье и понимания схемы лечения, прописанной врачом. Если вы обнаружили у себя схожие симптомы, обязательно обратитесь за помощью к доктору. Помните: самолечение может вам навредить.
Источник
00:00
Оксана Михайловна Драпкина, профессор:
– Приступим к дальнейшей программе. У нас будет лекция доцента Лапиной Татьяны Львовны, посвященная атрофическому гастриту (АГ).
Татьяна Львовна Лапина, доцент:
– Уважаемые коллеги! Тема моей лекции: «Атрофический гастрит – скрытая угроза: как поставить диагноз и помочь больному».
Зачем вообще нужно ставить диагноз атрофического гастрита?
Все дело в том, что уже многие десятилетия ясно, что АГ и такое изменение слизистой оболочки желудка, которое называется кишечной метаплазией (это маркер, признак АГ), являются предраковыми заболеваниями желудка.
Хронический гастрит и АГ, как правило, не имеют своей симптоматики. Не имея явной симптоматики, гастрит «молчит» о себе. Атрофия слизистой оболочки о себе никак не заявляет. Но молчание это очень громкое и грозное, потому что в итоге мы можем получить опухоль желудка.
Открытие пилорического хеликобактера в этой цепочке патогенетических событий от хронического гастрита к раку желудка позволило очень четко показать, что именно этот микроорганизм является причиной хронического воспаления слизистой оболочки желудка.
Действительно, абсолютно четко доказано, что для инфекции пилорического хеликобактера связь с АГ очевидна.
(Демонстрация слайда).
Посмотрите, пожалуйста. Это данные недавнего мета-анализа, которые четко связывают наличие инфекции пилорического хеликобактера с частотой случаев АГ. Суммарный относительный риск составляет 5. Многократно наличие инфекции пилорического хеликобактера усиливает риск АГ.
Естественно, пилорический хеликобактер как таковой связан с тем раком желудка, который в качестве своего предракового изменения имеет АГ. С некардиальным раком желудка, а именно с диффузной аденокарциномой кишечного типа по классификации Lauren.
02:48
Посмотрите, пожалуйста. Специально представляю данные мета-анализа по связи с инфекцией пилорического хеликобактера некардиального рака желудка и рака кардии. Рак кардии не связан с АГ. Четко видно, что нет связи с инфекцией пилорического хеликобактера.
Дистальный рак желудка кишечного типа имеет в качестве стадии определенный, предшествующий своему развитию АГ. Он четко связан с инфекцией пилорического хеликобактера.
Почему пилорический хеликобактер может привести к формированию рака желудка? В первую очередь, через воспалительные изменения слизистой оболочки – через гастрит.
Сама бактерия непосредственна. Например, благодаря тем эпигенетическим изменениям, которые инфекция пилорического хеликобактера вызывает в эпителиоцитах слизистой оболочки желудка.
На этой схеме, которая взята из очень хорошего обзора (он так и называется «Воспаление, атрофия и рак желудка») очень четко показано, что на молекулярном уровне ясно, какие события в эпителиоците желудка запускает инфекция пилорического хеликобактера. В результате может происходить дисбаланс процессов пролиферации, апоптоза, накапливаться генетические мутации.
Конечно, интересно понять, можно ли с помощью эрадикации пилорического хеликобактера добиться профилактики рака желудка.
Самые яркие работы – это работы по проведении эрадикационной терапии у пациентов, у которых диагностирован ранний рак желудка. Это работы японские. Вы знаете, что в этой стране очень хороший алгоритм ведения таких пациентов. Пациенты с ранним раком желудка подлежат эндоскопической резекции опухоли.
Посмотрите, пожалуйста: 544 больных после эндоскопической резекции раннего рака желудка наблюдались три года. Половине из них провели эрадикацию инфекции пилорического хеликобактера, половине не провели.
Через три года у пациентов после эрадикационной терапии случаи нового обнаружения опухолей желудка составили 3%. Пациенты, у которых осталась инфекция пилорического хеликобактера, в течение 3-х лет наблюдения – практически 9%. В три раза чаще выявлялась новая опухоль желудка.
05:47
Очень легко все представить на этой модели эндоскопической резекции рака желудка. На самом деле, эпидемиологические исследования по предотвращению рака желудка с помощью эрадикации пилорического хеликобактера очень сложно претворить в жизнь, очень сложно составить правильный план таких исследований.
Тем не менее, видно, что такие исследования проводятся. Действительно, из анализа этих исследований делается вывод, что эрадикация пилорического хеликобактера статистически значимо снижает частоту рака желудка примерно на 1/3.
Исходя из этих расчетов, в качестве некоторых рекомендаций определенных сообществ врачей даются рекомендации по возможному проведению скрининга инфекции пилорического хеликобактера в популяции. Особенно в тех популяциях, где высока частота инфекции пилорического хеликобактера.
Эрадикация инфекции у серопозитивных лиц как стратегия и мера профилактики рака желудка.
(Демонстрация слайда).
С точки зрения разработки такого алгоритма по профилактике рака желудка в Японии интересна эта статья очень известных исследователей. Благодаря их расчетам для Японии: возраст пациентов, когда была проведена эрадикационная терапия инфекции пилорического хеликобактера, и возможное снижение частоты рака желудка.
Вы видите, чем более молодой возраст (в зависимости от пола), тем более эффективна эрадикационная терапия как мера профилактики рака желудка.
С точки зрения диагностики атрофии рекомендуется использовать так называемый уровень сывороточного пепсиногена I. Это белок, который вырабатывается главными клетками желез тела желудка. При АГ утрачиваются железы и главные клетки, поэтому уровень сывороточного пепсиногена достоверно понижается. Определенные пороговые значения могут свидетельствовать о наличии атрофии тела желудка.
08:47
В зависимости от наличия инфекции пилорического хеликобактера и наличия сывороточного пепсиногена в низком титре как маркера атрофии выделяются определенные группы лиц популяции, которые могут подлежать (а могут и не подлежать) дальнейшему наблюдению.
Естественно, лица без инфекции пилорического хеликобактера и те, у кого сывороточный пепсиноген в норме, не требуют дальнейшего наблюдения. Но если речь идет о наличии инфекции пилорического хеликобактера, обязательно имеется в виду эрадикационная терапия.
Особенно тяжелая группа: пилорический хеликобактер + и сывороточный пепсиноген как маркер атрофии низкий. Есть специальная группа больных, когда атрофия зашла настолько глубоко, что пепсиноген низкий. Даже не определяется антитело к пилорическому хеликобактеру.
Эти пациенты должны подлежать эндоскопическому исследованию ежегодно после проведения эрадикационной терапии.
Наиболее интересна работа, которая говорит о профилактических мероприятиях с точки зрения профилактики рака желудка. Это работа Ванга (B. C. Wahg) и соавторов. Она выполнена в регионе с высокой частотой рака желудка. Наблюдалась в течение многих лет когорта из 1630 лиц. При этом почти 1000 из них на момент вовлечения в исследования не имели АГ и маркера АГ (кишечной метаплазии). У них не было выявлено дисплазии.
После эрадикационной терапии и группа сравнения, которая получала плацебо. Частота выявления рака желудка спустя годы наблюдения 7 человек и 11 человек с раком желудка.
Разницы вроде бы никакой нет. Но когда посмотрели пациентов, у которых эрадикационная терапия была начата до формирования признаков АГ, кишечной метаплазии, без дисплазии, то в результате наблюдения ноль случаев опухоли желудка. Шесть случаев диагностированного рака желудка при отсутствии эрадикации пилорического хеликобактера.
Конечно, присутствуют независимые факторы риска: курение, возраст пациентов. Тем не менее, в этом исследовании прекрасно доказано, что чем раньше начата эрадикационная терапия (может быть, до развития АГ), тем лучше эта мера действует с точки зрения профилактики.
12:03
Кому и когда проводить лечение?
Вы видите, перечислен ряд болезней и состояний, которые могут считаться показаниями для эрадикации инфекции пилорического хеликобактера.
Действительно, здесь присутствует АГ. Но будем ли мы проводить широкомасштабный скрининг на сывороточный пепсиноген и на антитела к пилорическому хеликобактеру? Пока мало регионов в России, в которых такие работы ведутся широкомасштабно.
Что делать практическому врачу?
Практическому врачу нужно использовать рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции пилорического хеликобактера у взрослых. Они были разработаны группой экспертов в результате, на мой взгляд, очень живого и длительного обсуждения и опубликованы в № 1 российского журнала «Гастроэнтерология, гепатология, колопроктология» за текущий (2012-й) год.
Назначение эрадикационной терапии желательно при хроническом гастрите, вызванном инфекцией пилорического хеликобактера. В том числе при АГ.
Пациент, у которого НПВС-гастропатия, гастроэзофагеально-рефлюксная болезнь, функциональная диспепсия, который пришел к доктору, предъявляя определенные жалобы, который настроен на проведение эзофагогастродуоденоскопии, гастроэнтерологического обследования – конечно, всегда следует иметь в виду диагностику инфекции пилорического хеликобактера. По возможности широкое назначение эрадикационной терапии, если это показано и если нет противопоказаний.
Как мы будем назначать эрадикационную терапию?
Мы будем назначать, конечно, хорошо зарекомендовавшую себя стандартную тройную терапию.
Ингибитор протонной помпы (ИПП) в стандартной дозе 2 раза в сутки. «Кларитромицин» (“Clarithromycin”) – грамм в сутки. «Амоксициллин» (“Amoxicillin”) – 1 грамм в сутки. Возможна комбинация «Кларитромицина» с «Метронидазолом» (“Metronidazolum”).
Российские рекомендации по ведению пациентов с инфекцией пилорического хеликобактера рекомендуют определенные методы, которые могут усилить эффект от стандартной тройной терапии.
Например, назначение дважды в сутки высокой дозы ИПП, удвоенной по сравнению со стандартной дозировкой.
15:00
Мне бы хотелось обратить ваше внимание на тот пункт, который помечен восклицательным знаком. Добавление к стандартной тройной терапии препарата «Висмута трикалия дицитрата» (“Bismuthate tripotassium dicitrate”).
ИПП в стандартной дозе 2 раза в сутки. «Кларитромицин», «Амоксициллин» и «Висмут трикалия дицитрат» 240 мг 2 раза в сутки.
Я должна сказать, что соли «Висмута» крайне интересны и с точки зрения включения их в эрадикационную терапию, и с точки зрения возможного назначения при хроническом гастрите и АГ.
Одна из самых надежных схем лечения включает соль «Висмута». Например, «Висмут трикалия дицитрат». Это классическая квадротерапия с препаратом «Висмута». Она рекомендуется и в качестве терапии 1-й линии, и как стандартная тройная терапия.
В каких ситуациях?
Например, в ситуации, когда вы хотите однозначно добиться эрадикации, потому что квадротерапия – это очень мощное лечение.
Когда у нас встретилась MALT-лимфома желудка, ассоциированная с пилорическим хеликобактером, мы пациентке назначили квадротерапию, нисколько не сомневаясь в нашем решении.
Возможно, пациент не переносит антибиотики пенициллинового ряда, поэтому стандартная тройная терапия, которая может включать «Амоксициллин», в этой ситуации невозможна к применению. Мы обращаемся к квадротерапии.
Если мы провели стандартную тройную терапию, и все-таки она не оказалась эффективной, в качестве 2-й лечебной линии выбираем квадротерапию с препаратом «Висмута».
Это действительно очень надежное лечение. Посмотрите, пожалуйста, работу 2011-го года. Квадротерапия на 14 и 10 дней. Даже по очень жесткому критерию эффективности Intention to treat (ITT) 92% эрадикации, причем и 10, и 14 дней.
На предыдущем слайде в рекомендациях Российской гастроэнтерологической ассоциации вы видели рекомендуемую продолжительность квадротерапии – 10 дней.
17:50
Препараты «Висмута» – это препараты, с самого начала «хеликобактерной эры», применявшиеся для эрадикации пилорического хеликобактера.
Первооткрыватель бактерии H.pylori Барри Маршалл (Barry Marshall) придумал назначать препараты «Висмута» для проведения эрадикационной терапии инфекции пилорического хеликобактера.
В результате многолетних исследований сформировался более или менее ясный алгоритм проведения эрадикационной терапии, который и положен в основу рекомендаций Российской гастроэнтерологической ассоциации по этому вопросу.
Конечно, есть разные исследования. Есть исследования, которые говорят о низкой эффективности тройной терапии. Вот работа, которая показывает низкую эффективность и тройной терапии, и не очень высокую эффективность квадротерапии.
Хотя для реальной клинической практики 77-78%. По большому счету, это очень близко к желанным 80%. Можно поспорить, насколько этот показатель для реальной практической деятельности является показателем провала схемы.
Мне бы хотелось обратить ваше внимание на поиски эффективности комбинации различных препаратов. Я вам показывала, что рекомендует Российская гастроэнтерологическая ассоциация: усиление стандартной тройной терапии препаратом «Висмута».
Недавно проведенное исследование в регионе, где резистентность к «Метронидазолу» 42%, к «Кларитромицину» 18%. Высокие уровни резистентности. Неизвестно, что назначить.
Назначили стандартную тройную терапию с препаратом «Висмута». Получили прекрасный процент эрадикации – 80% по жесткому критерию подсчета эффективности по критерию ITT (Intention to treat).
20:15
Этот подход – прибавление «Висмута» к эрадикационной терапии – не новый. Это подход, который в разные годы поисков оптимальной эрадикационной терапии занимает то одну ступеньку, то другую. То он ближе к терапии 1-й линии, то чуть-чуть дальше от нее.
(Демонстрация слайда).
Огромный мета-анализ. 93 рандомизированных контролируемых исследования. Ели вы посмотрите последнюю группу работ, это четырехкомпонентные терапии. Это та самая терапия «Метранидазол»-«Тетрациклин»-«Висмут» и антисекреторный препарат.
Вместе с тем различные другие варианты присоединения «Висмута» к стандартной тройной терапии.
Такое добавление этого специального антихеликобатерного препарата, конечно, существенно может прибавить к эффективности эрадикации.
Как нам вести пациентов с гастритом, в том числе с АГ.
Это рекомендации Российской гастроэнтерологической ассоциации, основанные на алгоритме, предложенном Владимиром Трофимовичем Ивашкиным, в 2008-м году.
Мы рекомендуем с точки зрения профилактики рака желудка при гастрите:
• сбалансированный рацион;
• возможно, прием антиоксидантов;
• отказ от курения, концентрированного алкоголя.
Специфическая профилактика при наличии инфекции пилорического хеликобактера – это эрадикация пилорического хеликобактера. Но препараты «Висмута», безусловно, занимают здесь определенную нишу.
За счет чего?
Посмотрите, пожалуйста, как рекомендует Российская гастроэнтерологическая ассоциация. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии по желанию врача, по его мнению, возможно продолжить лечение препаратом «Висмута» до 4-8 недель для реализации защитных свойств этого препарата.
Вы знаете, что препараты «Висмута», помимо антихеликобактерной активности, обладают очень мощным потенциалом по защите клеток слизистой оболочки желудка.
Наверное, к цитопротективным эффектам «Висмута» мы еще вернемся в следующих лекциях.
Благодарю вас за внимание.
Источник
